题目内容
【题目】分析下图所示的四个装置,其中结论正确的是( )
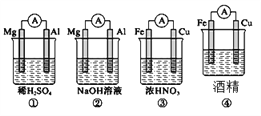
A. ①②中Mg作负极,③④)中Fe作负极
B. ②中Mg作正极,电极反应为6H2O+6e-===6OH-+3H2↑
C. ③中Fe作负极,电极反应为Fe-2e-===Fe2+
D. ④中Fe作负极,电极反应为Fe-2e-===Fe2+
【答案】B
【解析】A、①中Mg、Al均能与H2SO4发生自发的氧化还原反应,Mg比Al活泼,Mg作负极;②中Al与NaOH发生自发的氧化还原反应,而Mg不反应,故负极为Al;③中Fe在浓硝酸中发生钝化,反应不能持续进行,Cu与浓硝酸能自发发生氧化还原反应,故Cu作负极;④中酒精为非电解质,不能构成原电池,A错误。B、②中Al与NaOH发生自发的氧化还原反应,而Mg不反应,故负极为Al,Mg作正极,水中的H+得到电子生成氢气,电极方程式为6H2O+6e-===6OH-+3H2↑,B正确。C、③中Fe在浓硝酸中发生钝化,反应不能持续进行,Cu与浓硝酸能自发发生氧化还原反应,故Cu作负极,Fe为正极,HNO3在正极上得电子生成NO2,电极方程式为:2H++NO3-+ e-=NO2↑+H2O,C错误。D、④中酒精为非电解质,不能构成原电池,D错误。正确答案为B。

 活力课时同步练习册系列答案
活力课时同步练习册系列答案【题目】I、在下列物质转化中A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是酸,当X无论是强酸还是强碱时,都有如下的转化关系:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
当X是强酸时,A、B、C、D、E均含同一种元素;当X是强碱时,A、B、C、D、E均含另外的同一种元素。请回答:
(1)A的化学式是______, Z的电子式是______。
(2)当X是强酸时,写出C→D的化学方程式:_____。
(3)当X是强碱时,写出E的稀溶液和铜反应生成C的离子方程式:_____。
II、在FeSO4溶液中加入(NH4)2SO4固体可制备摩尔盐晶体[(NH4)2SO4·FeSO4·6H2O] (其相对分子质量为392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
(4)为了洗涤(NH4)2SO4·FeSO4·6H2O粗产品,下列方法中最合适的是____(填字母代号)。
A.用冷水洗 B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
(5)为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol·L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
①上表中第一次实验中记录数据明显大于后两次,其原因可能是_____(填字母代号)。
A.滴定前滴定管尖嘴无气泡,滴定结束有气泡
B.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
C.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
D.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
②通过实验数据计算的该产品纯度为_____(用字母a、c表示)。