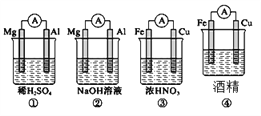
题目内容
【题目】CO2既是温室气体,也是重要的化工原料。以CO2为原料可合成多种物质。
(1)利用CO2和CH4重整可制合成气(主要成分CO、H2),重整过程中部分反应的热化学方程式为:
①CH4(g) = C(s) + 2H2(g) △H = +75.0 kJ·mol1
②CO2(g) + H2(g) = CO(g) + H2O(g) △H = +41.0 kJ·mol1
③CO(g) + H2(g) = C(s) + H2O(g) △H = -131.0 kJ·mol1
反应CO2(g) + CH4(g) = 2CO(g) + 2H2(g)的△H= ____。
(2)在一定温度下,向2L固定容积的密闭容器中通入2 mol CO2和6 mol H2发生反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0。测得CO2和CH3OH(g)浓度随时间变化如下图所示。
CH3OH(g)+H2O(g) △H<0。测得CO2和CH3OH(g)浓度随时间变化如下图所示。
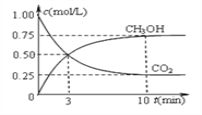
①前10 min内的平均反应速率υ(H2)=____ mol∕(L·min)。
②能说明该反应已达平衡状态的是____。
A.c(CO2):c(H2):c(CH3OH):c(H2O)=1:3:1:1
B.混合气体的平均摩尔质量保持不变
C.CH3OH的体积分数在混合气体中保持不变
D.混合气体的密度不随时间变化
③下列措施能使n(CH3OH) ∕n(CO2) 增大的是____。
A.升高温度 B.恒温恒容充入He(g)
C.使用高效催化剂 D.恒温恒容下,再充入1mol CO2、3mol H2
④该温度下的平衡常数K=____(L∕mol)2。
(3)用100mL 0.25 mol∕L Na2CO3溶液吸收标准状况下336mL的CO2气体(溶液体积变化忽略不计),所得溶液中:c(HCO3)+c(CO32)+c(H2CO3)=____ mol∕L(填数字)。
(4)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如图所示。

① b电极的名称是____。
② 请写出电解时生成乙烯的电极反应式____。
【答案】 +247 kJ·mol-1 0.225 B、C D 16/3或5.33 0.4 正 2CO2+12H++12e-=C2H4+4H2O
【解析】试题分析:(1)根据盖斯定律计算CO2(g) + CH4(g) = 2CO(g) + 2H2(g)的△H;(2)①根据![]() 计算υ(H2);②根据化学平衡的特征分析;③根据平衡移动原理分析n(CH3OH) ∕n(CO2)的变化;④根据
计算υ(H2);②根据化学平衡的特征分析;③根据平衡移动原理分析n(CH3OH) ∕n(CO2)的变化;④根据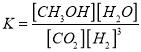 计算;(3)根据碳元素守恒计算;(4)根据图示,电解池中阳离子移向阴极,H+向左移动,所以a是负极、b是正极;二氧化碳得电子生成乙烯;
计算;(3)根据碳元素守恒计算;(4)根据图示,电解池中阳离子移向阴极,H+向左移动,所以a是负极、b是正极;二氧化碳得电子生成乙烯;
解析:(1)①CH4(g) = C(s) + 2H2(g) △H = +75.0 kJ·mol1
②CO2(g) + H2(g) = CO(g) + H2O(g) △H = +41.0 kJ·mol1
③CO(g) + H2(g) = C(s) + H2O(g) △H = -131.0 kJ·mol1
根据盖斯定律,②+①-③得CO2(g) + CH4(g) = 2CO(g) + 2H2(g)的△H=+247 kJ·mol-1;(2)①υ(H2)= ![]() 0.225 mol∕(L·min);②A.c(CO2):c(H2):c(CH3OH):c(H2O)=1:3:1:1时,不一定不再变化,所以不能说明该反应已达平衡状态;
0.225 mol∕(L·min);②A.c(CO2):c(H2):c(CH3OH):c(H2O)=1:3:1:1时,不一定不再变化,所以不能说明该反应已达平衡状态;
B.根据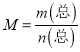 ,气体质量不变、总物质的量是变量,所以混合气体的平均摩尔质量是变量,变量保持不变一定达到平衡状态;
,气体质量不变、总物质的量是变量,所以混合气体的平均摩尔质量是变量,变量保持不变一定达到平衡状态;
C.CH3OH的体积分数在混合气体中保持不变,说明甲醇的物质的量不变,能说明该反应已达平衡状态;
D.气体总质量不变、容器体积不变,根据![]() ,混合气体的密度是恒量,密度不随时间变化,不能说明该反应已达平衡状态;选BC。
,混合气体的密度是恒量,密度不随时间变化,不能说明该反应已达平衡状态;选BC。
③A.正反应放热,升高温度逆向移动,n(CH3OH) ∕n(CO2) 减小; B.恒温恒容充入He(g),平衡不移动,n(CH3OH) ∕n(CO2)不变;C.使用高效催化剂,平衡不移动,n(CH3OH) ∕n(CO2)不变;D.恒温恒容下,再充入1mol CO2、3mol H2,相当于加压,平衡正向移动,n(CH3OH) ∕n(CO2) 增大;选D。
④根据图示达到平衡时![]() 、
、![]() 、
、![]() 、
、![]() ,平衡常数K=
,平衡常数K= 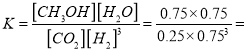 =5.33 (L∕mol)2。
=5.33 (L∕mol)2。
(3)用100mL 0.25 mol∕L Na2CO3溶液吸收标准状况下336mL的CO2气体,所得溶液中碳元素的物质的量是0.04mol,浓度是0.4 mol∕L,根据碳元素守恒c(HCO3)+c(CO32)+c(H2CO3)= 0.4 mol∕L。
(4)(4)①根据图示,电解池中阳离子移向阴极,H+向左移动,所以a是负极、b是正极;②在酸性电解质中二氧化碳得电子生成乙烯的电极反应式是2CO2+12H++12e-=C2H4+4H2O。

 特高级教师点拨系列答案
特高级教师点拨系列答案