��Ŀ����
��14�֣� 2SO2(g)+ O2 (g)  2 SO3 (g)�������������Ҫ��Ӧ֮һ���±���ԭ������V(SO2):V(O2):V(N2)=7:11:82Ͷ�ϣ���1��01��105Paʱ����ͬ�¶���SO2��ƽ��ת���ʡ�
2 SO3 (g)�������������Ҫ��Ӧ֮һ���±���ԭ������V(SO2):V(O2):V(N2)=7:11:82Ͷ�ϣ���1��01��105Paʱ����ͬ�¶���SO2��ƽ��ת���ʡ�
��1���÷�Ӧ��______��Ӧ������ȡ������ȡ�����
��2��400�棬1��01��105Paʱ������10 mol SO2��ԭ����ͨ��һ�ܱ������н��з�Ӧ��ƽ��ʱSO2�����ʵ�����______mol��
��3�����᳧β������Ҫ�ɷ�SO2��O2��N2���е�Ũ��SO2�������кܶ����
���ð�ˮ��������β������SO2�백ˮǡ�÷�Ӧ�õ����Ե�(NH4)2SO3��Һʱ�����йظ���Һ�����й�ϵ��ȷ����______������ţ���
a�� c + c(NH3?H2O)=" 2[c()+" c()+ c(H2SO3)]
b�� c()+ c(H+)=" c()+" c()+ c(OH-)
c�� c()> c() > c(OH-) > c(H+)
���� MnO2��ˮ������Һ��������β��������MnSO4��
i�� �õ�MnSO4�Ļ�ѧ����ʽ��______��
ii�������չ�������MnSO4ʱ����Һ��pH�仯������ͼ�ף�SO2����������ҺpH�Ĺ�ϵ��ͼ�ҡ�

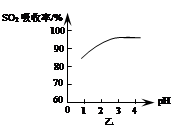
ͼ����pH�仯����Ϊ�������в���SO2ת��ΪH2SO4������H2SO4��Ӧ�Ļ�ѧ����ʽ��______����ͼ�ҿ�֪pH�Ľ���______SO2�����գ�������ڡ������ڡ������û�ѧƽ���ƶ�ԭ��������ԭ����______��
 2 SO3 (g)�������������Ҫ��Ӧ֮һ���±���ԭ������V(SO2):V(O2):V(N2)=7:11:82Ͷ�ϣ���1��01��105Paʱ����ͬ�¶���SO2��ƽ��ת���ʡ�
2 SO3 (g)�������������Ҫ��Ӧ֮һ���±���ԭ������V(SO2):V(O2):V(N2)=7:11:82Ͷ�ϣ���1��01��105Paʱ����ͬ�¶���SO2��ƽ��ת���ʡ�| �¶�/�� | 400 | 500 | 600 |
| SO2ת����/% | 99��2 | 93��5 | 73��7 |
��2��400�棬1��01��105Paʱ������10 mol SO2��ԭ����ͨ��һ�ܱ������н��з�Ӧ��ƽ��ʱSO2�����ʵ�����______mol��
��3�����᳧β������Ҫ�ɷ�SO2��O2��N2���е�Ũ��SO2�������кܶ����
���ð�ˮ��������β������SO2�백ˮǡ�÷�Ӧ�õ����Ե�(NH4)2SO3��Һʱ�����йظ���Һ�����й�ϵ��ȷ����______������ţ���
a�� c + c(NH3?H2O)=" 2[c()+" c()+ c(H2SO3)]
b�� c()+ c(H+)=" c()+" c()+ c(OH-)
c�� c()> c() > c(OH-) > c(H+)
���� MnO2��ˮ������Һ��������β��������MnSO4��
i�� �õ�MnSO4�Ļ�ѧ����ʽ��______��
ii�������չ�������MnSO4ʱ����Һ��pH�仯������ͼ�ף�SO2����������ҺpH�Ĺ�ϵ��ͼ�ҡ�

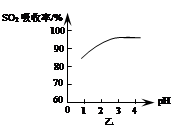
ͼ����pH�仯����Ϊ�������в���SO2ת��ΪH2SO4������H2SO4��Ӧ�Ļ�ѧ����ʽ��______����ͼ�ҿ�֪pH�Ľ���______SO2�����գ�������ڡ������ڡ������û�ѧƽ���ƶ�ԭ��������ԭ����______��
��14�֣�
��1������ 0��08
��2����ac
i�� SO2+ H2O H2SO3 MnO2+ H2SO3===MnSO4+H2O����MnO2+ SO2==MnSO4��
H2SO3 MnO2+ H2SO3===MnSO4+H2O����MnO2+ SO2==MnSO4��
ii�� 2SO2+ 2H2O +O2 ="==" 2H2SO4
������ ��Һ�д��� SO2+ H2O H2SO3
H2SO3 H++������Һ��������ǿ��ƽ�������ƶ���ʹSO2����ϵ�������
H++������Һ��������ǿ��ƽ�������ƶ���ʹSO2����ϵ�������
��1������ 0��08
��2����ac
i�� SO2+ H2O
 H2SO3 MnO2+ H2SO3===MnSO4+H2O����MnO2+ SO2==MnSO4��
H2SO3 MnO2+ H2SO3===MnSO4+H2O����MnO2+ SO2==MnSO4��ii�� 2SO2+ 2H2O +O2 ="==" 2H2SO4
������ ��Һ�д��� SO2+ H2O
 H2SO3
H2SO3 H++������Һ��������ǿ��ƽ�������ƶ���ʹSO2����ϵ�������
H++������Һ��������ǿ��ƽ�������ƶ���ʹSO2����ϵ������������������1���¶����߶��������ת���ʽ��ͣ�˵�������¶�ƽ�������ƶ�����������Ϊ���ȷ�Ӧ��
��2���������¶��������ת����Ϊ99��2%������10 mol SO2��ԭ����ƽ��ʱʣ��10��(1-99��2%)=0��08mol SO2
��3���ٸ��������غ���ɣ�c��NH4+��+c(NH3��H2O)=2c(H2SO3)+2c(SO32-)+ 2c(HSO3-)��a��ȷ��b�����ϵ���غ���ɣ�����NH4��2SO3��ҺΪ������Һ��˵��SO32-��ˮ��̶ȴ���NH4+��ˮ��̶ȣ�������Һ������Ũ�ȵĴ�С��ϵ��c��NH4+��>c(SO32-)>c(OH-)>c(H+)��c��ȷ����ѡac��
��i������������ˮ��Ӧ���������ᣬ��������������̷���������ԭ��Ӧ���������̣���ѧ����ʽΪH2O+SO2
 H2SO3 MnO2+ H2SO3= MnSO4+H2O��
H2SO3 MnO2+ H2SO3= MnSO4+H2O��ii��SO2��ˮ��������Ӧ�������ᣬ��ѧ����ʽΪ2SO2+2H2O+ O2="2" H2SO4������ͼ��֪��pH��С������������������½�������pH�Ľ��Ͳ�����SO2�����գ���Ϊ������������ˮ�����ƽ��H2O+SO2
 H2SO3
H2SO3 H++ HSO3-������Һ��������ǿ��ƽ�������ƶ���ʹ�����������ϵ���ݳ���
H++ HSO3-������Һ��������ǿ��ƽ�������ƶ���ʹ�����������ϵ���ݳ���
��ϰ��ϵ�д�
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
�����Ŀ
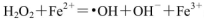
 ����Fe2���ڴ˹����������������______________��������336mL O2����״����ʱ����Ӧ��ת�Ƶ��ӵ����ʵ���Ϊ_______mol��
����Fe2���ڴ˹����������������______________��������336mL O2����״����ʱ����Ӧ��ת�Ƶ��ӵ����ʵ���Ϊ_______mol��
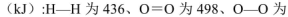
 .
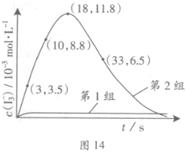
.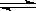 Z �ڷ�Ӧ�����еķ�Ӧ���ʣ�v����ʱ�䣨t���Ĺ�ϵ���ߣ�������������ȷ���� �� ��
Z �ڷ�Ӧ�����еķ�Ӧ���ʣ�v����ʱ�䣨t���Ĺ�ϵ���ߣ�������������ȷ���� �� �� 
 x Q(g)+3R(g)����2min��ƽ�⣬����2.4molR�������Q��Ũ��Ϊ0.4mol/L����
x Q(g)+3R(g)����2min��ƽ�⣬����2.4molR�������Q��Ũ��Ϊ0.4mol/L����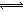 HOI(aq) ��H2
HOI(aq) ��H2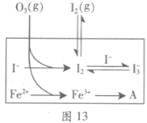
 2SO3(g)������������Ӧ���ʵĴ�ʩ�ǣ� ��
2SO3(g)������������Ӧ���ʵĴ�ʩ�ǣ� ��