题目内容
下列各组金属与酸的反应,反应刚开始时,放出H2的速率最大的是( )
| | 金属(粉末状)/mol | 酸的浓度及体积 | 反应温度 | ||
| A | Mg | 0.1 | 3mol·L-1盐酸 | 10mL | 25℃ |
| B | Fe | 0.1 | 3mol·L-1盐酸 | 10mL | 25℃ |
| C | Mg | 0.1 | 3mol·L-1硫酸 | 10mL | 25℃ |
| D | Mg | 0.1 | 6mol·L-1硝酸 | 10mL | 60℃ |
C
试题分析:由于硝酸有强氧化性,与金属反应一般不产生氢气。排除D选项。对于A、B、二个选项来说,酸的浓度相等,反应的温度相同,则由于金属性Mg>Fe。所以A比B反应速率快。对于A、C来说金属相同,反应温度相同,但是c(H+)C比A大。物质的浓度越大,反应速率就越快。因此反应放出氢气的速率最快的是C。

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
 2C(s)+3D(g) 已知该反应在不同温度下的平衡常数如下表:
2C(s)+3D(g) 已知该反应在不同温度下的平衡常数如下表: 2 SO3 (g)是生产硫酸的主要反应之一。下表是原料气按V(SO2):V(O2):V(N2)=7:11:82投料,在1.01×105Pa时,不同温度下SO2的平衡转化率。
2 SO3 (g)是生产硫酸的主要反应之一。下表是原料气按V(SO2):V(O2):V(N2)=7:11:82投料,在1.01×105Pa时,不同温度下SO2的平衡转化率。
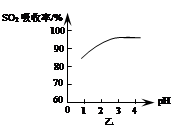
 2NH3(g)△H=-92.4kJ/mol,实验测得起始、平衡时的有关数据如下表:
2NH3(g)△H=-92.4kJ/mol,实验测得起始、平衡时的有关数据如下表: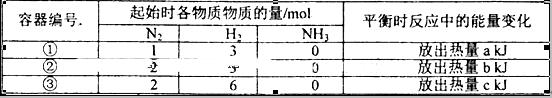
 Z(g) △H<0,反应经60s达到平衡并生成0.3 mol Z,则下列说法中正确的是
Z(g) △H<0,反应经60s达到平衡并生成0.3 mol Z,则下列说法中正确的是 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下图和下表表示。下列说法正确的是
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下图和下表表示。下列说法正确的是
 xC(g)。2 min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol·L-1,请填写下列空白:
xC(g)。2 min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol·L-1,请填写下列空白: