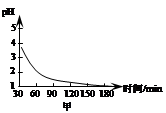题目内容
(17分)H2O2是一种强氧化剂,被广泛应用于水处理及卫生消毒等方面。
(1)H2O2不稳定,当其中含Fe2+时,会发生反应: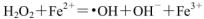
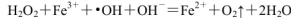 ,则Fe2+在此过程中所起的作用是______________,当生成336mL O2(标准状况)时,反应中转移电子的物质的量为_______mol。
,则Fe2+在此过程中所起的作用是______________,当生成336mL O2(标准状况)时,反应中转移电子的物质的量为_______mol。
(2)下表是在常压、60℃和不同pH条件下,6mL30% H2O2在60min内释放出氧气的体积。则下列说法正确的是___________。
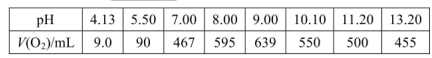
a.pH越大,H2O2的分解速率越大
b.pH在9左右,H2O2的分解速率最大
c.6mL 30% H2O2分解最多释放出的氧气的体积为639mL
d. pH=5.50时,0~60min内,v(O2)=1.5mL
(3)溶液中H2O2的残留量可用一定浓度的酸性KMnO4溶液来测定,反应中MnO4-
被还原为Mn2+,该反应的离子方程式为______________。
(4)科学工作者以Ir-Ru/Ti为阳极、ACFC为阴极,在酸性环境、不断通入空气的条件下直接电解水来制备H2O2。电解过程中,阳极区溶液的pH_ (填“增大”“不变”或“减小”),阴极产生H2O2的电极反应式为_______。若不通空气,则阴极得到的产物是_______ 。
(5)己知断裂1mol化学键所需的能量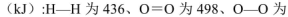
143,H-O为463。则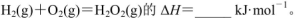 .
.
(1)H2O2不稳定,当其中含Fe2+时,会发生反应:
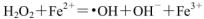
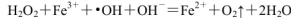 ,则Fe2+在此过程中所起的作用是______________,当生成336mL O2(标准状况)时,反应中转移电子的物质的量为_______mol。
,则Fe2+在此过程中所起的作用是______________,当生成336mL O2(标准状况)时,反应中转移电子的物质的量为_______mol。(2)下表是在常压、60℃和不同pH条件下,6mL30% H2O2在60min内释放出氧气的体积。则下列说法正确的是___________。

a.pH越大,H2O2的分解速率越大
b.pH在9左右,H2O2的分解速率最大
c.6mL 30% H2O2分解最多释放出的氧气的体积为639mL
d. pH=5.50时,0~60min内,v(O2)=1.5mL

(3)溶液中H2O2的残留量可用一定浓度的酸性KMnO4溶液来测定,反应中MnO4-
被还原为Mn2+,该反应的离子方程式为______________。
(4)科学工作者以Ir-Ru/Ti为阳极、ACFC为阴极,在酸性环境、不断通入空气的条件下直接电解水来制备H2O2。电解过程中,阳极区溶液的pH_ (填“增大”“不变”或“减小”),阴极产生H2O2的电极反应式为_______。若不通空气,则阴极得到的产物是_______ 。
(5)己知断裂1mol化学键所需的能量
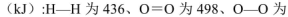
143,H-O为463。则
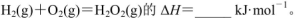 .
.(17分)
(1)催化作用(或催化剂)(2分) 0.03(2分)
(2)bd(2分)
(3)5H2O2+2MnO4-+6H+=2Mn2++5O2↑+8H2O(3分)
(4)减小(2分) O2+2H++2e-==H2O2(2分) H2(2分)
(5)-135(2分)
(1)催化作用(或催化剂)(2分) 0.03(2分)
(2)bd(2分)
(3)5H2O2+2MnO4-+6H+=2Mn2++5O2↑+8H2O(3分)
(4)减小(2分) O2+2H++2e-==H2O2(2分) H2(2分)
(5)-135(2分)
试题分析:(1)反应的总方程式为2H2O2═2H2O+O2↑,所以Fe2+起到催化剂的作用;O元素由-1价升高至0价,所以对应关系为:O2 ~ 2e?,n(e?)=2×0.336L÷22.4L/mol=0.03mol。
(2)a、pH大于9.00时,反应速率又逐渐减小,错误;b、根据表中数据,pH在9左右,H2O2的分解速率最大,正确;c、60min后反应还可能继续进行,所以6mL 30%的H2O2分解最多释放出的氧气的体积可能大于639mL,错误;d、v(O2)=90mL÷60min=1.5mLmin-1,正确。
(3)MnO4?把H2O2氧化为O2,配平可得离子方程式为:5H2O2+2MnO4-+6H+=2Mn2++5O2↑+8H2O
(4)阳极H2O失去电子生成的产物含H+,H+浓度增大,所以阳极区溶液的pH减小;阴极O2得电子产生H2O2,电极反应式为:O2+2H++2e-=H2O2;若不通空气,阴极上H+得电子,则阴极得到的产物是H2。
(5)根据各物质含有的共价键可得:?H=436kJ?mol?1+498kJ?mol?1—143kJ?mol?1—2×463kJ?mol?1=-135kJ?mol?1。

练习册系列答案
相关题目
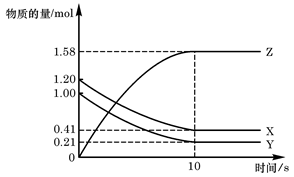
 Z(g)
Z(g) xC(g)+2D(g),5min后反应达平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L.min).求:
xC(g)+2D(g),5min后反应达平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L.min).求: N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是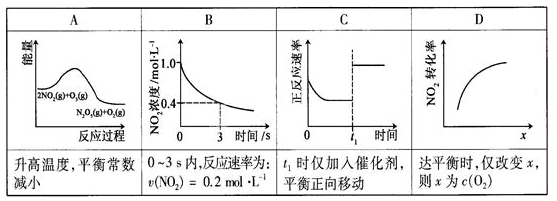
 3Z(g) + W(s) ΔH>0 的叙述正确的是
3Z(g) + W(s) ΔH>0 的叙述正确的是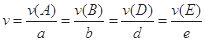 。式中
。式中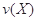 指物质
指物质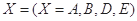 的反应速率,
的反应速率,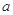 、
、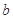 、
、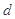 、
、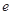 是化学计量数。298k时,测得溶液中的反应H2O2+2HI=2H2O+I2在不同浓度时化学反应速率v见下表:
是化学计量数。298k时,测得溶液中的反应H2O2+2HI=2H2O+I2在不同浓度时化学反应速率v见下表: (H2O2)相等
(H2O2)相等 2SO3(g)体系中,n(SO2)随时间的变化如下表:
2SO3(g)体系中,n(SO2)随时间的变化如下表:
 2 SO3 (g)是生产硫酸的主要反应之一。下表是原料气按V(SO2):V(O2):V(N2)=7:11:82投料,在1.01×105Pa时,不同温度下SO2的平衡转化率。
2 SO3 (g)是生产硫酸的主要反应之一。下表是原料气按V(SO2):V(O2):V(N2)=7:11:82投料,在1.01×105Pa时,不同温度下SO2的平衡转化率。