题目内容
在一定条件下,在容积为2L的密闭容器中,将2mol气体M和3mol气体N混合,发生如下反应:2M(g)+ 3N(g)  x Q(g)+3R(g),经2min达平衡,生成2.4molR,并测得Q的浓度为0.4mol/L。求:
x Q(g)+3R(g),经2min达平衡,生成2.4molR,并测得Q的浓度为0.4mol/L。求:
(1)用气体M来表示该反应的化学反应速率是多少?
(2)反应前后的压强比是多少?
(3)N的转化率是多少?
(4)平衡时气体Q所占的体积分数为多少?
 x Q(g)+3R(g),经2min达平衡,生成2.4molR,并测得Q的浓度为0.4mol/L。求:
x Q(g)+3R(g),经2min达平衡,生成2.4molR,并测得Q的浓度为0.4mol/L。求:(1)用气体M来表示该反应的化学反应速率是多少?
(2)反应前后的压强比是多少?
(3)N的转化率是多少?
(4)平衡时气体Q所占的体积分数为多少?
(1)0.4mol/(L·min)
(2)反应前后的压强比是5/4.2
(3)80%
(4)19%
(2)反应前后的压强比是5/4.2
(3)80%
(4)19%
试题分析:根据题中信息、物质反应的物质的量之比等于化学计量数之比和化学方程式列出“三行式”,
2M(g)+ 3N(g)
 x Q(g)+3R(g)
x Q(g)+3R(g)开始的物质的量 2mol 3mol 0 0
反应的物质的量 1.6mol 2.4mol 0.4mol/L×2L 2.4mol
2min后物质的量 0.4mol 0.6mol 0.8mol 2.4mol
根据物质的量之比等于化学计量数之比,x=1。
(1)v(M)= △c(M)÷t=△n(M)÷V÷t=1.6mol÷2L÷2min=0.4mol/(L·min)。
(2)根据压强之比等于物质的量之比,故反应前后的压强比是(2mol+3mol)/( 0.4mol+0.6mol+0.8mol+2.4mol)=5/4.2。
(3) N的转化率是2.4mol÷3mol×100%=80%。
(4) 平衡时气体Q所占的体积分数为0.8mol÷( 0.4mol+0.6mol+0.8mol+2.4mol)×100%=19%。

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
 N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是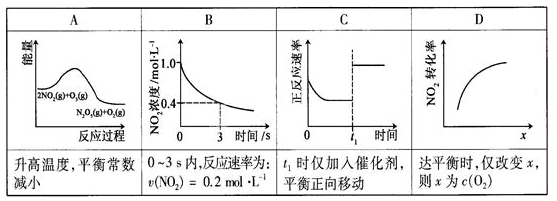
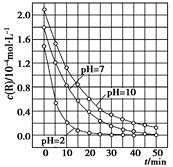
 2SO3(g)体系中,n(SO2)随时间的变化如下表:
2SO3(g)体系中,n(SO2)随时间的变化如下表:
 Pb(s) + CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表
Pb(s) + CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表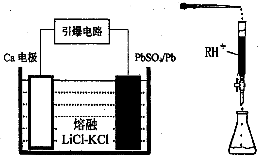
 2C(s)+3D(g) 已知该反应在不同温度下的平衡常数如下表:
2C(s)+3D(g) 已知该反应在不同温度下的平衡常数如下表:
 2AB3(g)的ΔH>0
2AB3(g)的ΔH>0 2 SO3 (g)是生产硫酸的主要反应之一。下表是原料气按V(SO2):V(O2):V(N2)=7:11:82投料,在1.01×105Pa时,不同温度下SO2的平衡转化率。
2 SO3 (g)是生产硫酸的主要反应之一。下表是原料气按V(SO2):V(O2):V(N2)=7:11:82投料,在1.01×105Pa时,不同温度下SO2的平衡转化率。
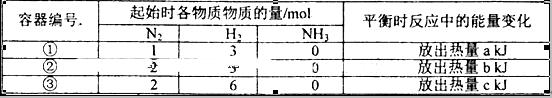
 2NH3(g)△H=-92.4kJ/mol,实验测得起始、平衡时的有关数据如下表:
2NH3(g)△H=-92.4kJ/mol,实验测得起始、平衡时的有关数据如下表: