题目内容
【题目】室温下,用0.1mol·L-1的盐酸分别滴定50mL的三种碱(AOH、BOH和DOH)溶液,滴定曲线如图所示,下列判断错误的是( )
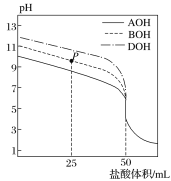
A.从反应开始至恰好完全反应,水电离出的c(H+)始终增大
B.滴定至P点时,溶液中:c(B+)>c(Cl-)>c(BOH)>c(OH-)>c(H+)
C.pH=7时,三种溶液中c(A+)=c(B+)=c(D+)
D.当盐酸体积为50 mL时,将三种溶液混合后:c(H+)=c(AOH)+c(BOH)+c(DOH)+c(OH-)
【答案】C
【解析】
A、根据图像,加入盐酸50 mL时,达到滴定终点,则三种碱液的浓度均为0.1 mol·L-1,由图中起点坐标可知三种碱均为弱碱,碱性强弱大小关系为AOH<BOH<DOH。从反应开始至恰好完全反应,不断生成可水解的盐,促进水的电离,故水电离出的c(H+)始终增大,故A正确;
B、滴定至P点时,溶质为BOH和BCl,且二者物质的量之比为1∶1,溶液呈碱性,说明BOH的电离程度大于B+的水解程度,故溶液中存在:c(B+)>c(Cl-)>c(BOH)>c(OH-)>c(H+),故B正确;
C、pH=7时,溶液中c(H+)=c(OH-),由电荷守恒可知,c(A+)、c(B+)、c(D+)分别与相应溶液中c(Cl-)相等,由图可知,pH=7时,c(Cl-)大小关系为A<B<D,则c(A+)<c(B+)<c(D+),故C错误;
D、当盐酸体积为50 mL时,三种溶液的溶质分别为ACl、BCl、DCl,将三种溶液混合后根据质子守恒可得c(H+)=c(AOH)+c(BOH)+c(DOH)+c(OH-),故D正确;
故选C。

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案【题目】某同学用食用油进行实验,以下是实验操作和现象:
实验操作 | 将食用油滴入水中 | 向食用油中滴加溴水 | 将少量食用油与纯碱(主要成分是 |
实验现象 | 食用油浮在水面上 | 溴水褪色 | 分层现象消失 |
下列关于食用油的实验结论不正确的是( )
A.食用油的密度比水小
B.食用油中含碳碳不饱和键
C.食用油在碱性条件下会水解生成可溶于水的物质
D.食用油是一种有机酸