题目内容
下图是一种航天器能量储存系统原理示意图。下列说法正确的是( )
| A.该系统中只存在3种形式的能量转化 |
| B.装置Y中负极的电极反应式为:O2+2H2O+4e-=4OH- |
| C.装置X能实现燃料电池的燃料和氧化剂再生 |
| D.装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化 |
C
解析试题分析:A、存在能量转化形式有太阳能、机械能、化学能、电能,则不只是三种,故A错误;B、装置Y为燃料电池,氢气在负极失电子被氧化,电极反应式是:H2-2e-+2OH-=2H2O,故B错误;C、在装置X中,电解水生成H2、O2,能实现燃料电池的燃料和氧化剂再生,故C正确;D、在装置X中,电解水生成H2、O2,实现了电能与化学能的转化;在装置Y中构成燃料电池,化学能转化为电能,作用于马达实现了电能与机械能的转化,故D错误,故选C。
考点:考查化学电源新型电池

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案实验室用NaOH固体配制0.1 000mol·L-1NaOH溶液500mL.
(1)用托盘天平称取NaOH固体________g.溶液配制过程用到下列玻璃仪器,按首次使用的先后顺序依次是________ (填仪器选项符号)
A.玻璃棒 B.胶头滴管 C.烧杯 D.500mL容量瓶
(2)用所配制的0.1000mol·L-1NaOH溶液通过中和滴定测定一元弱酸HA溶液浓度,每次滴定取用的HA溶液均为20.00mL,使用酚酞溶液为指示剂,滴定终点的标志是____________________________。滴定的实验数据记录:
| 滴定次数 | NaOH溶液体积(mL) | |
| V1 | V2 | |
| 1 | 3.05 | 44 |
| 2 | 1.45 | 41.5 |
| 3 | 7.65 | 47.6 |
处理以上实验数据,测得该HA溶液物质的量浓度为____________________。
(3)上述中和滴定实验中,以下操作可能导致所测溶液浓度偏高的是__________(填选项符号)
A.滴定管用待装液润洗
B.锥形瓶用待装液润洗
C.滴定前滴定管末端气泡没赶尽
D.滴定前平视观察读数,滴定后俯视观察读数
E.所用的标准液(NaOH溶液)浓度偏高
(4)用pH计测得该HA溶液pH=a,结合上述中和滴定结果可推算实验温度下HA的Ka=________。
某氯化铁样品含有少FeC12杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行: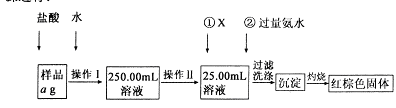
请根据上图流程,回答以下问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 (填仪器名称),操作Ⅱ必须用到的仪器是 (填编号)。
| A.50mL烧杯 | B.50mL量筒 | C.100mL量筒 | D.25mL酸式滴定管 |
(3)检验沉淀是否已经洗涤干净的操作是 。
(4)若蒸发皿质量是W1g,蒸发皿与加热后固体总质量W2g,则样品中铁元素的质量分数是 (列出计算式,不需化简):若固体加热时未充分反应,则最终测量的结果 (“偏大”、“偏小”、“不变”)。
(5)已知在常温下Cu2+和Fe3+在溶液中随pH变化时水解的曲线如图所示
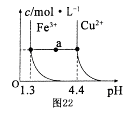 。
。对图中a点的说法正确的是 (填序号)。
①加适量NH4C1固体可使溶液由a点沿水平方向变到Cu2+曲线上。
②溶液中a点和水平线在Fe3+和Cu2+曲线上任意截点的C(H+)与c(OH-)乘积相等
③Fe(OH)3、Cu(OH)2在a点代表的溶液中均达到饱和
某原电池装置如下图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是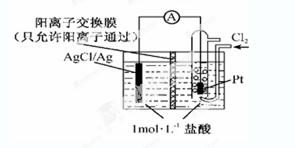
| A.正极反应为AgCl +e-=Ag +Cl- |
| B.放电时,交换膜右侧溶液中有大量白色沉淀生成 |
| C.若用NaCl溶液代替盐酸,则电池总反应随之改变 |
| D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子 |
金属M和N可构成如图所示的装置.下列分析正确的是 
| A.金属活泼性N>M |
| B.M逐渐溶解 |
| C.负极反应为2H++2e- =H2↑ |
| D.SO42-向M极定向移动 |
下列叙述错误的是( )
| A.废弃的干电池不能随意丢弃,但可以土埋处理 |
| B.马口铁(镀锡铁)镀层破损后即失去保护作用 |
| C.不能将铁制自来水管与铜制水龙头连接使用 |
| D.电化学腐蚀过程中存在电极反应,产生微电流 |
蓄电池在放电时起原电池作用,在充电时起电解池作用。下面是爱迪生蓄电池分别在充电和放电时发生的反应:Fe+NiO2+2H2O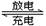 Fe(OH)2+Ni(OH)2。下列有关爱迪生蓄电池的说法正确的是
Fe(OH)2+Ni(OH)2。下列有关爱迪生蓄电池的说法正确的是
| A.放电时,Fe是负极,发生还原反应,NiO2是正极,发生氧化反应 |
| B.蓄电池的电极可以浸入某种酸性电解质溶液中 |
| C.放电时,电解质溶液中的阴离子向正极方向移动 |
| D.充电时,阴极上的电极反应式为:Fe(OH)2+2e-=Fe+2OH- |
