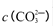题目内容
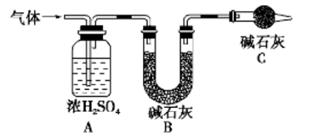
草酸合铁(Ⅲ)酸钾晶体Kx[Fey(C2O4)z]·nH2O可用于摄影和蓝色印刷。为确定其组成,某化学兴趣小组在没有氧气干扰下进行如下实验:
实验Ⅰ.草酸根含量的测定
称取0.9820 g样品放入锥形瓶中,加入适量稀硫酸和一定量水,加热至343~358 K,用0.2000
mol/LKMnO4溶液滴定,滴定过程中草酸根离子转变成CO2逸出反应容器,KMnO4转变成Mn2+。达到滴定终点时,共消耗KMnO4溶液12.00 ml。
实验Ⅱ.铁含量的测定
将上述滴定过草酸根的保留液充分加热,使淡紫红色消失。冷却后,调节溶液pH并加入过量的KI固体,充分反应后调节pH至7左右,滴入几滴淀粉溶液做指示剂,用0.2500mol·L-1 Na2S2O3标准溶液滴定至终点,共消耗Na2S2O3溶液8.00 ml。(已知:实验Ⅱ中涉及的部分离子方程式为:I2+2S2O32-=2I-+S4O62-)
请根据上述实验回答下列问题
(1)实验Ⅰ在滴定过程中反应的离子方程式为 。
(2)MnO4-在酸性条件下,加热能分解为O2,同时生成Mn2+。若实验Ⅱ中没有对实验Ⅰ的保留液进
行充分加热,则测定的Fe3+的含量将会 (填“偏高”、“偏低” 或“不变”)。
(3)实验Ⅱ用淀粉溶液做指示剂,则滴定终点观察到的现象为 。
(4)通过计算确定样品晶体的组成(写出计算过程)。
(1)2MnO4-+5H2C2O4+6H+=2Mn2++8H2O+10CO2↑(2分)
(2)偏高(2分)
(3)滴下最后一滴Na2S2O3标准溶液,溶液由蓝色变成无色,且半分钟内不变色(2分)
(4)(6分)
2MnO4- ~ ~~~~5C2O42- 2S2O32- ~ I2~ 2 Fe3+
2 5 2 2
0.2×12×10-3mol n(C2O42-) 0.25×8×10-3mol n(Fe3+)
解得n(C2O42-) = 6×10-3mol (1分) n(Fe3+) = 2×10-3mol (1分)
根据电荷守恒原理:n(K+) =6×10-3mol (1分)
根据质量守恒原理m(H2O) =0.9820-39×6×10-3-56×2×10-3-88×6×10-3=0.108g
n(H2O)=6×10-3 mol (1分)
n(K+):n(Fe3+):n(C2O42-):n(H2O)=3:1:3:3 (1分)
所以化学式为:K3Fe(C2O4)3·3H2O (1分)
解析试题分析:(1)高锰酸钾具有强氧化性,能把草酸氧化生成CO2,而还原产物是Mn2+,反应的化学方程式为2MnO4-+5H2C2O4+6H+=2Mn2++8H2O+10CO2↑。
(2)若实验Ⅱ中没有对实验Ⅰ的保留液进行充分加热,则溶液中有剩余的MnO4-,MnO4-能氧化I-生成单质碘,从而导致与单质碘反应的Na2S2O3溶液的体积增加,因此使测定的Fe3+的含量将会偏高。
(3)由于单质碘遇淀粉显蓝色,所以终点时的实验现象是滴下最后一滴Na2S2O3标准溶液,溶液由蓝色变成无色,且半分钟内不变色。
(4)根据题意并结合有关的反应方程式可知
2MnO4- ~ ~~~~5C2O42- 2S2O32- ~ I2~ 2 Fe3+
2 5 2 2
0.2×12×10-3mol n(C2O42-) 0.25×8×10-3mol n(Fe3+)
解得n(C2O42-) = 6×10-3mol n(Fe3+) = 2×10-3mol
根据电荷守恒原理:n(K+) =6×10-3mol
根据质量守恒原理m(H2O) =0.9820-39×6×10-3-56×2×10-3-88×6×10-3=0.108g
n(H2O)=6×10-3 mol
n(K+):n(Fe3+):n(C2O42-):n(H2O)=3:1:3:3
所以化学式为:K3Fe(C2O4)3·3H2O
考点:考查氧化还原反应滴定实验的有关判断、应用以及物质组成的有关计算

某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
实验一:配制并标定醋酸溶液的浓度
取冰醋酸配制250 mL 0.2 mol·L-1的醋酸溶液,用0.2 mol·L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
(1)配制250 mL 0.2 mol·L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、 和 。
(2)为标定某醋酸溶液的准确浓度,用0.200 0 mol·L-1的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
则该醋酸溶液的准确浓度为 (保留小数点后四位)。
实验二:探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,结果如下:
| 醋酸浓度(mol·L-1) | 0.001 0 | 0.010 0 | 0.020 0 | 0.100 0 | 0.200 0 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
回答下列问题:
(1)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是: 。
(2)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度将 (填“增大”“减小”或“不变”)。
实验三:探究温度对醋酸电离程度的影响
请你设计一个实验完成该探究,请简述你的实验方案:
。
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液。
其操作可分解为如下几步:
a. 移取20.00mL待测的NaOH溶液注入洁净的锥形瓶,并加入2-3滴酚酞
b. 用标准盐酸溶液润洗滴定管2-3次
c. 把盛有标准溶液的酸式滴定管固定好,调节液面使滴定管尖嘴充满溶液
d. 取标准盐酸溶液注入酸式滴定管至0刻度以上2-3cm
e. 调节液面至0或0刻度以下,记下读数
f. 把锥形瓶放在滴定管的下面,用标准盐酸溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)__________________ ____。
(2)滴定终点时溶液的颜色变化是 。
(3)下列操作中可能使所测NaOH溶液的浓度数值偏低的是_____ ___。
| A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸 |
| B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
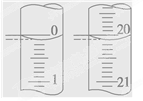
(5)某学生根据3次实验分别记录有关数据如下表:
| 滴定 次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.20 | 20.22 | |
| 第二次 | 25.00 | 0.56 | 24.54 | |
| 第三次 | 25.00 | 0.42 | 20.40 | |
依据上表数据求得NaOH溶液的物质的量浓度为 。
下列叙述是某同学做完铜锌原电池实验后得出的结论和认识,正确的是( )
| A.构成原电池正极和负极的材料必须是两种金属 |
| B.由铜锌作为电极与硫酸铜溶液组成的原电池中,铜是负极 |
| C.电流通过硫酸溶液,SO42- 向正极移动 |
| D.铜锌原电池工作时,若有13 g锌被溶解,电路中就有0.4 mol 电子通过 |
某原电池装置如下图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是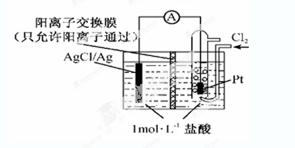
| A.正极反应为AgCl +e-=Ag +Cl- |
| B.放电时,交换膜右侧溶液中有大量白色沉淀生成 |
| C.若用NaCl溶液代替盐酸,则电池总反应随之改变 |
| D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子 |
氢氧燃料电池是一种新能源。下图为氢氧燃料电池示意图。下列说法不正确的是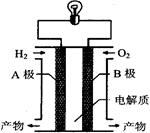
| A.电子由B极通过导线流向A极 |
| B.A极是负极,B极是正极 |
| C.该装置能将化学能转化为电能 |
| D.产物为无污染的水,属于环境友好电池 |
如图所示,下列叙述中正确的是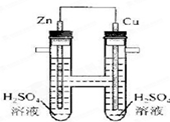
| A.正极发生氧化反应 | B.电子通过导线由铜流向锌 |
| C.负极有O2逸出 | D.铜上有H2逸出 |

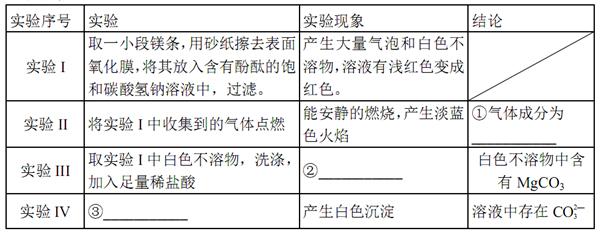
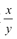 的值___(填“偏大”、“偏小”或“不变”
的值___(填“偏大”、“偏小”或“不变”