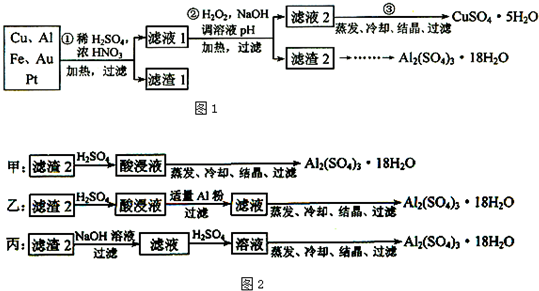
题目内容
18.往饱和澄清石灰水中投入一小块钠,充分反应后恢复到原来的温度.下列叙述正确的是( )| A. | 钠浮在水面,熔成小球四处游动,溶液变浑浊 | |
| B. | 溶液中Ca(OH)2的质量分数不变,有氢气放出 | |
| C. | 溶液底部产生银白色的固体 | |
| D. | 反应后的溶液中OH-、Ca2+浓度均不会改变 |
分析 Na先和H2O反应,方程式为2Na+2H2O=2NaOH+H2↑,该反应是放热反应,放出的热量导致溶液温度升高,Ca(OH)2的溶解度随着温度的升高而降低,据此分析解答.
解答 解:A.Na投入水溶液里或水中时,都是Na先好水反应,因为钠的密度小于水、熔点低,且该反应生成氢气,Ca(OH)2的溶解度随着温度的升高而降低,所以氢氧化钙饱和溶液投入Na后,有部分氢氧化钙析出,所以看到的现象为钠浮在水面,熔成小球四处游动,溶液变浑浊,故A正确;
B.反应后溶液中的溶质为Ca(OH)2、NaOH,温度不变仍是饱和溶液,溶液中氢氧化钙的质量分数减小,故B错误;
C.钠和水反应,不能置换出Ca,所以溶液底部不会产生银白色的固体,故C错误;
D.反应后析出氢氧化钙固体,溶液中的溶质为Ca(OH)2、NaOH,氢氧化钙仍然是饱和溶液,则Ca2+浓度不变,氢氧化钠溶解度大于氢氧化钙,OH-浓度增大,故D错误;
故选A.
点评 本题考查了钠和水的反应及氢氧化钙的性质,钠与盐溶液反应的现象既具有钠和水反应的现象,也有氢氧化钙性质的现象,注意氢氧化钙溶解度特点,为易错点,题目较简单.

练习册系列答案
相关题目
8.已知10mL Na2R溶液含Na+的微粒数为N个,该Na2R溶液的物质的量浓度为( )
| A. | N×10-2 mol/L | B. | $\frac{N}{1.204×1{0}^{22}}$ mol/L | ||
| C. | $\frac{N}{6.02×1{0}^{21}}$mol/L | D. | $\frac{N}{6.02×1{0}^{25}}$mol/L |
9.下列叙述正确的是( )
| A. | 氯化钠溶液在电流作用下电离成钠离子和氯离子所以能导电 | |
| B. | 二氧化硫的水溶液能导电,所以二氧化硫是电解质 | |
| C. | 硫酸钡难溶于水,但硫酸钡属于电解质 | |
| D. | 液态氯化氢不导电,所以氯化氢是非电解质 |
6.下列化合物中既可以发生消去反应生成烯烃,又可以发生水解反应的是( )
| A. | CH3Cl | B. | CCl3C Cl3 | C. | 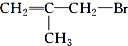 | D. | 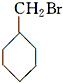 |