题目内容
3.Al3+、A1(OH)3、A1O2-之间的转化关系如图:
写出上述转化的离子方程式.
分析 (1)氨水与铝离子反应生成沉淀;
(2)氢氧化铝和强酸反应生成铝离子;
(3)铝离子与过量强碱反应生成偏铝酸根离子;
(4)偏铝酸根离子与强酸反应生成铝离子;
(5)偏铝酸根离子与二氧化碳或少量强酸反应生成氢氧化铝;
(6)氢氧化铝和强碱反应生成偏铝酸根离子.
解答 解:(1)氨水与铝离子反应生成沉淀,离子反应为Al3++3NH3•H2O═Al(OH)3↓+3NH4+;
(2)氢氧化铝和强酸反应生成铝离子,离子反应为Al(OH)3+3H+═Al3++3H2O;
(3)铝离子与过量强碱反应生成偏铝酸根离子,离子反应为Al3++4OH-═AlO2-+2H2O;
(4)偏铝酸根离子与强酸反应生成铝离子,离子反应为AlO2-+4H+═Al3++2H2O;
(5)偏铝酸根离子与二氧化碳或少量强酸反应生成氢氧化铝,离子反应为AlO2-+H2O+H+═Al(OH)3↓或AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-;
(6)氢氧化铝和强碱反应生成偏铝酸根离子,离子反应为Al(OH)3+OH-═AlO2-+2H2O,
答:转化离子反应分别为Al3++3NH3•H2O═Al(OH)3↓+3NH4+、Al(OH)3+3H+═Al3++3H2O、Al3++4OH-═AlO2-+2H2O、AlO2-+4H+═Al3++2H2O、AlO2-+H2O+H+═Al(OH)3↓或AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-、Al(OH)3+OH-═AlO2-+2H2O.
点评 本题考查铝及其化合物的性质及离子反应,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应的离子反应考查,题目难度不大.

练习册系列答案
相关题目
18.往饱和澄清石灰水中投入一小块钠,充分反应后恢复到原来的温度.下列叙述正确的是( )
| A. | 钠浮在水面,熔成小球四处游动,溶液变浑浊 | |
| B. | 溶液中Ca(OH)2的质量分数不变,有氢气放出 | |
| C. | 溶液底部产生银白色的固体 | |
| D. | 反应后的溶液中OH-、Ca2+浓度均不会改变 |
8.荧火黄既可用作颜料,也用作指示剂,其合成路线如下图:
下列有关说法正确的是( )

下列有关说法正确的是( )
| A. | 1 mol荧火黄完全燃烧消耗标准状况下氧气体积为459.2L | |
| B. | 荧火黄分子中含有两种含氧官能团 | |
| C. | 1 mol荧火黄最多可与含4 mol NaOH的溶液完全反应 | |
| D. | 荧火黄的分子式为C20H14O5 |
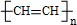 、
、 .
. 饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一.某《化学教育》杂志报道了如下实验研究:
饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一.某《化学教育》杂志报道了如下实验研究: