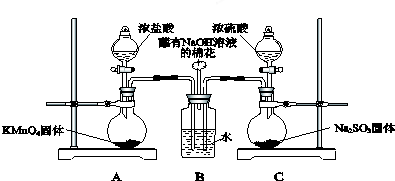
题目内容
18.1,2-二溴乙烷汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18g/mL,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇,醚、丙酮等有机溶剂.在实验中可以用如图所示装置制备1,2-二溴乙烷.其中分液漏斗和烧瓶a中装有乙醇和浓H2SO4的混合液,试管d中装有液溴(表面覆盖少量水).填写下列空白: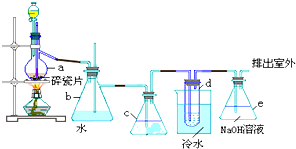
(1)写出本题中制备1,2-二溴乙烷有关的两个化学方程式.
①CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O;②CH2=CH2+Br2→CH2BrCH2Br.
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞.请写出发生堵塞时b瓶中的现象b中水面会下降,玻璃管中的水柱会上升,甚至溢出.
(3)容器c中所装的试剂是NaOH溶液,其作用是除去乙烯中带出的SO2、CO2等酸性气体杂质,以防止其杂质与溴反应.
(4)d中用冷水冷却液溴的原因是避免溴大量挥发,但又不能过度冷却(如用冰水),其原因是产品1,2-二溴乙烷的熔点低,过度冷却会凝固而堵塞导管.
分析 实验原理:乙醇和浓硫酸反应主要生成乙烯气体,反应为:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O,还可能混有碳和浓硫酸反应生成的CO2和SO2气体,b为安全瓶,c为净化除杂装置,d为乙烯和溴的反应装置,反应为:CH2=CH2+Br2→CH2BrCH2Br,e为尾气吸收装置.
(1)实验室中用乙醇和浓硫酸加热来制取乙烯,然后用乙烯和溴单质的加成反应来制得1,2-二溴乙烷;
(2)依据当d堵塞时,气体不畅通,则在b中气体产生的压强将水压入直玻璃管中,甚至溢出玻璃管;
(3)根据上面的分析可知,乙烯中可能有CO2和SO2等酸性气体,对实验有干扰,所以要除去,C为净化装置,混合气体通过c瓶,CO2和SO2气体被氢氧化钠吸收,以防止其杂质与溴反应;
(4)溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发;但1,2-二溴乙烷的凝固点9℃较低,不能过度冷却,否则1,2-二溴乙烷凝固而堵塞导管.
解答 解:(1)实验室中用乙醇和浓硫酸加热来制取乙烯,然后用乙烯和溴单质的加成反应来制得1,2-二溴乙烷,发生反应的化学方程式为:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O,CH2=CH2+Br2→CH2BrCH2Br,
故答案为:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O;CH2=CH2+Br2→CH2BrCH2Br;
(2)试管d发生堵塞时,b中压强不断增大,会导致b中水面下降,玻璃管中的水柱上升,甚至溢出,
故答案为:b中水面会下降,玻璃管中的水柱会上升,甚至溢出;
(3)a中浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,CH3CH2OH+4H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4SO2↑+CO2↑+7H2O+C,二氧化碳、二氧化硫能和氢氧化钠溶液反应而被吸收,反应为:SO2+2NaOH=Na2SO3+H2O,CO2+2NaOH═Na2CO3+H2O,所以容器c中所装的试剂是NaOH溶液,除去乙烯中带出的SO2、CO2等酸性气体杂质,以防止其杂质与溴反应,
故答案为:NaOH溶液;除去乙烯中带出的SO2、CO2等酸性气体杂质,以防止其杂质与溴反应;
(4)溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,但1,2-二溴乙烷的凝固点9℃较低,不能过度冷却,过度冷却会使其凝固而使气路堵塞,
故答案为:避免溴大量挥发;产品1,2-二溴乙烷的熔点低,过度冷却会凝固而堵塞导管.
点评 本题考查了制备实验方案的设计、溴乙烷的制取方法,题目难度中等,注意掌握溴乙烷的制取原理、反应装置选择及除杂、提纯方法是解题的关键,注重培养学生分析问题、解决问题的能力.

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案①CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ/mol
②C(s)+O2(g)═CO2(g)△H2=-393.5kJ/mol
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H3=-285.8kJ/mol
则反应④2C(s)+2H2(g)+O2(g)═CH3COOH(l)的焓变为( )
| A. | 488.3 kJ/mol | B. | -224.15 kJ/mol | C. | -488.3 kJ/mol | D. | 244.15 kJ/mol |
| A. | 钠浮在水面,熔成小球四处游动,溶液变浑浊 | |
| B. | 溶液中Ca(OH)2的质量分数不变,有氢气放出 | |
| C. | 溶液底部产生银白色的固体 | |
| D. | 反应后的溶液中OH-、Ca2+浓度均不会改变 |
| A. | c1:c2>1:2 | |
| B. | A和B的转化率不相等 | |
| C. | 平衡时,B和C的生成速率之比1:1 | |
| D. | c2的取值范围为0<c2<0.28 mol•L-1 |
 饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一.某《化学教育》杂志报道了如下实验研究:
饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一.某《化学教育》杂志报道了如下实验研究:
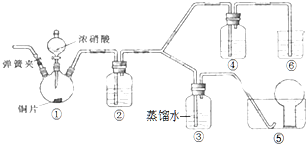 某学习小组探究浓、稀硝酸氧化性的相对强弱,按如图装置进行实验(夹持仪器已略去).实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO.由此得出的结论是浓硝酸的氧化性强于稀硝酸.
某学习小组探究浓、稀硝酸氧化性的相对强弱,按如图装置进行实验(夹持仪器已略去).实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO.由此得出的结论是浓硝酸的氧化性强于稀硝酸.