题目内容
19.方程式配平(1)1C2O72-+3H2O2-+8H+=2Cr3++3O2↑+7H2O
(2)3Fe3O4+28H++1NO3-=9Fe3+1+NO↑+14H2O
(3)3ClO-+1Fe(OH)3+4OH-=3Cl-+1 FeO42-+5H2O
(4)MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
(5)NaH在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe2O3)脱锈过程发生反应的化学方程式为3NaH+Fe2O3=2Fe+3NaOH.
分析 (1)反应中Cr化合价从+6价降低到+3价,双氧水中的O元素从-1价升高到0价,1molCr2O72-反应得到6mol电子,1molH2O2反应失去2mol电子,依据氧化还原反应得失电子守恒、原子个数守恒配平方程式;
(2)利用整体法,Fe3O4中铁元素化合价总数为+8价,生成3个Fe3+,共失去1个电子,硝酸中的N从+5价降为NO中的+2价,得到3个电子,依据氧化还原反应得失电子守恒、原子个数守恒配平方程式;
(3)反应中ClO-中的氯元素化合价从+1降低到-1,得到2个电子,铁元素从+3价升高为+6价,失去3个电子,依据氧化还原反应得失电子守恒、原子个数守恒配平方程式;
(4)反应中Mn元素从+7价降为+2价,1molMnO4-参加反应得到5mol电子,C元素从C2O42-中的+3价升高到二氧化碳中的+4价,1molC2O42-参加反应失去2mol电子,依据氧化还原反应得失电子守恒、原子个数守恒配平方程式;
(5)氢化钠与氧化铁发生氧化还原反应生成铁和氢氧化钠,据此写出方程式.
解答 解:(1)反应中Cr化合价从+6价降低到+3价,双氧水中的O元素从-1价升高到0价,1molCr2O72-反应得到6mol电子,1molH2O2反应失去2mol电子,要使得失电子守恒,Cr2O72-系数为1,H2O2系数为3,依据原子个数守恒,方程式为:Cr2O72-+3H2O2+8H+=3O2↑+2Cr3++7H2O;
故答案为:1;3;8;2;3;7;
(2)利用整体法,Fe3O4中铁元素化合价总数为+8价,生成3个Fe3+,共失去1个电子,硝酸中的N从+5价降为NO中的+2价,得到3个电子,要使得失电子守恒则,Fe3O4系数为3,NO3-系数为1,依据原子个数守恒,方程式:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O;
故答案为:3;28;1;9;1;14;
(3)反应中ClO-中的氯元素化合价从+1降低到-1,得到2个电子,铁元素从+3价升高为+6价,失去3个电子,要使得失电子守恒,则ClO-系数为3,Fe(OH)3系数为1,FeO42-系数为1,Cl-系数为3,依据原子个数守恒,方程式:3ClO-+Fe(OH)3+4OH-=3Cl-+FeO42-+5H2O;
故答案为:3;1;4OH-;3;1;5;
(4)反应中Mn元素从+7价降为+2价,1molMnO4-参加反应得到5mol电子,C元素从C2O42-中的+3价升高到二氧化碳中的+4价,1molC2O42-参加反应失去2mol电子,要使得失电子守恒,则MnO4-系数为2,C2O42-系数为3,依据原子个数守恒,方程式:2MnO4-+3C2O42-+16H+=2Mn2++10CO2↑+8H2O;
故答案为:2;3;16H+;2;10;8H2O;
(5)NaH常做还原剂(H化合价升高为+1价),铁锈在此为氧化剂(Fe化合价降低为0价),反应生成铁单质,化学反应方程式为:3NaH+Fe2O3=2Fe+3NaOH,
故答案为:3NaH+Fe2O3=2Fe+3NaOH.
点评 本题考查了氧化还原反应方程式配平,准确分析反应中各种元素化合价变化,熟悉氧化还原反应得失电子守恒规律是解题关键,题目难度中等.

| A. | 钠浮在水面,熔成小球四处游动,溶液变浑浊 | |
| B. | 溶液中Ca(OH)2的质量分数不变,有氢气放出 | |
| C. | 溶液底部产生银白色的固体 | |
| D. | 反应后的溶液中OH-、Ca2+浓度均不会改变 |
| A. | c1:c2>1:2 | |
| B. | A和B的转化率不相等 | |
| C. | 平衡时,B和C的生成速率之比1:1 | |
| D. | c2的取值范围为0<c2<0.28 mol•L-1 |
| A. | K+、CO32-、Cl-、NO3- | B. | MnO4-、K+、OH-、SO42- | ||
| C. | Cl-、SO42-、Cu2+、Ba2+ | D. | Mg2+、Na+、NO3-、Cl- |
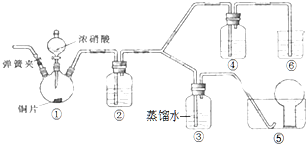 某学习小组探究浓、稀硝酸氧化性的相对强弱,按如图装置进行实验(夹持仪器已略去).实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO.由此得出的结论是浓硝酸的氧化性强于稀硝酸.
某学习小组探究浓、稀硝酸氧化性的相对强弱,按如图装置进行实验(夹持仪器已略去).实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO.由此得出的结论是浓硝酸的氧化性强于稀硝酸.
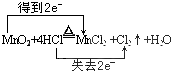 .
.