题目内容
1.信息时代产生的大量电子垃圾对环境构成了极大的威胁.某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线图1: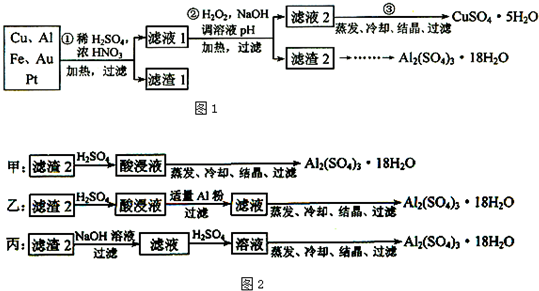
请回答下列问题:
(1)第①步Cu与酸反应的离子方程为Cu+4H++2NO3-$\frac{\underline{\;加热\;}}{\;}$Cu2++2NO2↑+2H2O 或3Cu+8H++2NO3-$\frac{\underline{\;加热\;}}{\;}$3Cu2++2NO↑+4H2O;
得到滤渣1的主要成分为Au、Pt.
(2)第②步加H2O2的作用是将Fe2+氧化为Fe3+,使用H2O2的优点是不引入杂质,对环境无污染;调溶液pH的目的是使Fe3+、Al3+生成沉淀.
(3)用第③步所得CuSO4•5H2O制备无水CuSO4的方法是加热脱水.
(4)由滤渣2制取Al2(SO4)3•18H2O,探究小组设计了三种方案如图2.上述三种方案中,甲方案不可行,原因是所得产品中含有较多Fe2(SO4)3杂质;
(5)探究小组用滴定法测定CuSO4•5H2O (Mr=250)含量.取a g试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用c
mol L-1EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL.滴定反应如下:Cu2++H2Y2-=CuY2-+2H+
写出计算CuSO4•5H2O质量分数的表达式ω=$\frac{cmol•{L}^{-1}×b×1{0}^{-3}L×250g•mo{l}^{-1}×5}{ag}×100%$;
下列操作会导致CuSO4•5H2O含量的测定结果偏高的是c.
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子.
分析 本题是以含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物制备硫酸铜和硫酸铝晶体的流程,涉及了用离子方程式表示反应原理,利用绿色氧化剂过氧化氢氧化二价铁离子得到三价铁,然后通过调整溶液的pH使Fe3+、Al3+沉淀,然后先用碱溶液溶解沉淀,过滤后再用酸溶解沉淀,得到的溶液再分别结晶,另外还涉及利用滴定原理测定胆矾晶体的质量分数,据此可作答;
(1)稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成Cu2+、Al3+、Fe2+;所以滤渣1 的成分是Pt和Au,滤液1中的离子是Cu2+、Al3+、Fe2+;
(2)过氧化氢具有氧化性且被还原为水,无杂质无污染;可以氧化亚铁离子为铁离子易于沉淀除去,调节溶液PH目的是铁离子和铝离子全部沉淀;第②步加H2O2的作用是把Fe2+氧化为Fe3+,该氧化剂的优点是不引入杂质,产物对环境无污染.调溶液PH的目的是使Fe3+和Al3+形成沉淀.所以滤液2的成分是Cu2+,滤渣2的成分为氢氧化铁和氢氧化铝;
(3)第③步由五水硫酸铜制备硫酸铜的方法应是在坩埚中加热脱水;
(4)依据实验方案过程分析制备晶体中是否含有杂质,使用的试剂作用,原料的利用率,原子利用率因素分析判断;
(5)依据滴定实验和反应离子方程式计算得到;滴定实验误差分析依据标准溶液消耗的多少进行分析判断.
解答 解:(1)稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成Cu2+、Al3+、Fe2+;所以滤渣1的成分是Pt和Au,滤液1中的离子是Cu2+、Al3+、Fe2+;第①步Cu与酸反应的离子方程式为:Cu+4H++2NO3-$\frac{\underline{\;加热\;}}{\;}$Cu2++2NO2↑+2H2O 或3Cu+8H++2NO3-$\frac{\underline{\;加热\;}}{\;}$3Cu2++2NO↑+4H2O,Au、Pt不能被硝酸溶解,就为滤渣;
故答案为:Cu+4H++2NO3-$\frac{\underline{\;加热\;}}{\;}$Cu2++2NO2↑+2H2O 或3Cu+8H++2NO3-$\frac{\underline{\;加热\;}}{\;}$3Cu2++2NO↑+4H2O;Au、Pt;
(2)第②步加H2O2的作用是将Fe2+氧化为Fe3+;过氧化氢做氧化剂不引入杂质,对环境无污染;调节溶液PH铁离子和铝离子全部沉淀后过滤得到氢氧化铁、氢氧化铝沉淀和滤液硫酸铜,故答案为:将Fe2+氧化为Fe3+;不引入杂质,对环境无污染;Fe3+、Al3+;
(3)第③步由五水硫酸铜制备硫酸铜的方法应是在坩埚中加热脱水;故答案为:加热脱水;
(4)制备硫酸铝晶体的甲、乙、丙三种方法中,甲方案在滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质,方法不可行;乙和丙方法均可行;乙方案先在滤渣中加H2SO4,生成Fe2(SO4)3和Al2(SO4)3,再加Al粉和Fe2(SO4)3生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体;丙方案先在滤渣中加NaOH和Al(OH)3反应生成NaAlO2,再在滤液中加H2SO4生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体,故答案为:甲;所得产品中含有较多Fe2(SO4)3杂质;
(5)取a g试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用c mol•L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL.滴定反应如下:Cu2++H2Y2-=CuY2-+2H+
铜离子物质的量和标准液物质的量相同=cmol/L×b×10-3L=bc×10-3mol;依据元素守恒得到:
则20ml溶液中含有的CuSO4•5H2O物质的量为bc×10-3mol;100ml溶液中含bc×10-3mol×5=5bc×10-3mol;
所以CuSO4•5H2O质量分数的表达式=$\frac{cmol•{L}^{-1}×b×1{0}^{-3}L×250g•mo{l}^{-1}×5}{ag}×100%$;
a.未干燥锥形瓶对实验结果无影响;
b.滴定终点时滴定管尖嘴中产生气泡说明消耗标准液读数偏小,结果偏低;
c.未除净可与EDTA反应的干扰离子,消耗标准液多,结果偏高;
故答案为:$\frac{cmol•{L}^{-1}×b×1{0}^{-3}L×250g•mo{l}^{-1}×5}{ag}×100%$;c.
点评 本题考查离子分离的方法,实验设计,试剂选择,中和滴定的简单计算和误差的分析,离子性质的熟练掌握是解题关键,题目难度中等.

| A. | 0.58 g/L | B. | 0.29 g/L | C. | 1.16 g/L | D. | 0.714 g/L |
| A. | 钠浮在水面,熔成小球四处游动,溶液变浑浊 | |
| B. | 溶液中Ca(OH)2的质量分数不变,有氢气放出 | |
| C. | 溶液底部产生银白色的固体 | |
| D. | 反应后的溶液中OH-、Ca2+浓度均不会改变 |
| A. | 0.1mol Cl2与足量Na0H溶液反应,转移电子的数目为0.2NA | |
| B. | 0.1mol苯乙烯中含有碳碳双键的数目为0.4NA | |
| C. | 4.6g由NO2和N204组成的混合物中含有氧原子的数目为0.2NA | |
| D. | 标准状况下,11.2L乙醇中含有羟基的数目为0.5NA |
| A. | c1:c2>1:2 | |
| B. | A和B的转化率不相等 | |
| C. | 平衡时,B和C的生成速率之比1:1 | |
| D. | c2的取值范围为0<c2<0.28 mol•L-1 |
| A. | K+、CO32-、Cl-、NO3- | B. | MnO4-、K+、OH-、SO42- | ||
| C. | Cl-、SO42-、Cu2+、Ba2+ | D. | Mg2+、Na+、NO3-、Cl- |


 +2H2O.
+2H2O. 饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一.某《化学教育》杂志报道了如下实验研究:
饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一.某《化学教育》杂志报道了如下实验研究: