题目内容
14.大气中SO2和NOx是形成酸雨的主要物质.某地酸雨中可能含有下列离子:Na+、Mg2+、Fe2+、NH4+、Cl-、SO32-、SO42-、NO3-等.某研究小组取该地一定量的酸雨,浓缩后将所得试液分成4份,进行如下实验:第一份酸化后滴加适量的淀粉KI溶液,呈蓝色;第二份滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出;第三份滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝;第四份加入硝酸酸化的AgNO3溶液,有沉淀产生.已知:Ksp(Ag2SO4)=1.20×10-5请回答下列问题:
(1)该酸雨中肯定存在的离子有SO42-、NO3-、NH4+;肯定不存在的离子有SO32-、Fe2+,说明其不存在的理由:SO32-、Fe2+具有较强的还原性,酸性条件下,与NO3-不能共存.
(2)写出试液中滴加淀粉KI溶液所发生反应的离子方程式:6I-+2NO3-+8H+=3I2+2NO↑+4H2O
(3)设计实验方案,检验该试液中是否存在Cl-:取少量试液,滴加足量的Ba(NO3)2溶液,静置,取上层清液,滴加硝酸酸化的AgNO3溶液,若有白色沉淀产生,则存在Cl-.
(4)该研究小组为了探究NO参与的硫酸型酸雨的形成,在烧瓶中充入含有少量NO的SO2气体,慢慢通入O2,该过程中发生的化学反应有2NO+O2=2NO2、NO2+SO2=SO3+NO,再喷射适量蒸馏水即得硫酸型酸雨.说明NO的作用:催化剂.
(5)该研究小组为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为做电解质溶液,形成原电池,该过程的总反应式为2Al+3Ag2S+6H2O═2Al(OH)3↓+6Ag+3H2S↑.
分析 (1)滴加适量的淀粉KI溶液,呈蓝色,说明在该酸性溶液中有一种能将碘离子氧化为碘单质的离子存在,而这样的离子只有NO3-,故一定含有NO3-,就一定不会含有SO32-、Fe2+;因为SO32-、Fe2+具有较强的还原性,酸性条件下,与NO3-不能共存;滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出,故一定含有SO42-;滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝,则有氨气生成,故一定含有NH4+;加入足量硝酸酸化的AgNO3溶液,有沉淀产生,由于存在SO42-,则氯离子的存在与否不能判断;
(2)硝酸根离子在酸性条件下将碘离子氧化成碘单质;
(3)根据氯离子的检验方法:加硝酸酸化的硝酸银后会产生白色沉淀,但要排除硫酸根的干扰;
(4)根据物质的性质来书写方程式,根据一氧化氮在反应中的特点来判断所起到的作用;
(5)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,该装置构成原电池,食盐水作电解质溶液,促进溶液的导电性,根据题中信息写出反应方程式.
解答 解:(1)滴加适量的淀粉KI溶液,呈蓝色,说明在该酸性溶液中有一种能将碘离子氧化为碘单质的离子存在,而这样的离子只有NO3-,故一定含有NO3-,就一定不会含有SO32-、Fe2+;因为SO32-、Fe2+具有较强的还原性,酸性条件下,与NO3-不能共存;滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出,故一定含有SO42-;滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝,则有氨气生成,故一定含有NH4+;加入足量硝酸酸化的AgNO3溶液,有沉淀产生,由于存在SO42-,则氯离子的存在与否不能判断,
故答案为:SO42-、NO3-、NH4+;SO32-、Fe2+;SO32-、Fe2+具有较强的还原性,酸性条件下,与NO3-不能共存;
(2)硝酸氧化碘离子的离子方程式为:6I-+2NO3-+8H+=3I2+2NO↑+4H2O,
故答案为:6I-+2NO3-+8H+=3I2+2NO↑+4H2O;
(3)氯离子的检验方法:加硝酸酸化的硝酸银后会产生白色沉淀,但要排除硫酸根的干扰,操作方法为:取少量试液,滴加足量的Ba(NO3)2溶液,静置,取上层清液,滴加硝酸酸化的AgNO3溶液,若有白色沉淀产生,则存在Cl-,
故答案为:取少量试液,滴加足量的Ba(NO3)2溶液,静置,取上层清液,滴加硝酸酸化的AgNO3溶液,若有白色沉淀产生,则存在Cl-;
(4)一氧化氮具有还原性,很容易被氧气氧化,方程式为:2NO+O2=2NO2,二氧化氮能将二氧化硫氧化,方程式为NO2+SO2=SO3+NO,整个过程一氧化氮的质量没有变化,故在反应中作催化剂,
故答案为:2NO+O2=2NO2;NO2+SO2=SO3+NO;催化剂;
(5)该装置构成原电池,氯化钠溶液作电解质溶液,促进溶液的导电能力,反应的总方程式为:2Al+3Ag2S+6H2O═2Al(OH)3↓+6Ag+3H2S↑,
故答案为:做电解质溶液,形成原电池;2Al+3Ag2S+6H2O═2Al(OH)3↓+6Ag+3H2S↑.
点评 本题考查了常见离子的检验方法,题目难度中等,涉及离子推断、离子方程式、化学方程式书写等知识,明确常见离子的性质及检验方法为解答关键,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及灵活应用能力.

 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案| A. | PM2.5含有的铅、镊、铬、钒、砷等对人体有害的元素均是金属元素 | |
| B. | 合成纤维和光导纤维都是有机高分子化合物 | |
| C. | 可以用SiN4、Al2O3,制作高温结构陶瓷制品 | |
| D. | 绿色化学的核心是应用化学原理对环境污染进行治理 |
| A. | 鱼 | B. | 大米 | C. | 葡萄 | D. | 植物油 |
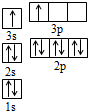 (1)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于水分子间存在氢键.
(1)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于水分子间存在氢键.(2)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是非极性(填“极性”或“非极性”)分子.
(3)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4>H3PO4; HClO4>HClO3;
(4)A和B的单质单位质量的燃烧热大,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
②根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为直线形.
| A. | 碳氢键 | B. | 碳碳键 | C. | 氢氧键 | D. | 碳氧单键 |
| A. | ${\;}_{53}^{131}$I和${\;}_{53}^{134}$I是同一种核素 | |
| B. | ${\;}_{53}^{131}$I和${\;}_{53}^{134}$I互为同位素 | |
| C. | ${\;}_{53}^{131}$I和${\;}_{53}^{134}$I都含有53个电子 | |
| D. | ${\;}_{53}^{131}$I和${\;}_{53}^{134}$I都含有53个中子 |

 +6KMnO4+9H2SO4→
+6KMnO4+9H2SO4→ +3K2SO4+6MnSO4+14H2O.
+3K2SO4+6MnSO4+14H2O.