题目内容
9.现有前四周期T、X、Y、Z、W、M六种元素,已知W、Z、X、T、Y五种非金属元素原子半径依次减小,其中W原子的s电子总数等于p电子总数的2倍.M原子的M能层上有4个未成对电子.请完成下列问题:(1)写出W、Z、X、T四种元素第一电离能由大到小的顺序(用元素符号表示)F>N>O>C.
(2)M原子的基态电子排布式为1s22s22p63s23p63d64s2或[Ar]3d64s2.
(3)根据VESPR理论,推断出由W与X两元素组成的最简单二价阴离子的空间构型为平面三角形,W原子的杂化类型为sp2杂化.
(4)Y与T、X、Z、W所形成的最简单化合物的沸点由高到低顺序为(用化学式表示):H2O>HF>NH3>CH4.
分析 W的s能级上电子总数等于p能级上电子总数的2倍,则电子排布式为:1s22s22p2,故W为C;W、Z、X、T、Y五种非金属元素原子半径依次减小,则该5种非金属元素处于相同周期,故Z为N、X为O、T为F、Y为H;M原子的M能层上有4个未成对电子,则电子排布式为:1s22s22p63s23p63d64s2,则M为Fe,据此进行解答.
解答 解:W的s能级上电子总数等于p能级上电子总数的2倍,则电子排布式为:1s22s22p2,故W为C;W、Z、X、T、Y五种非金属元素原子半径依次减小,则该5种非金属元素处于相同周期,故Z为N、X为O、T为F、Y为H;M原子的M能层上有4个未成对电子,则电子排布式为:1s22s22p63s23p63d64s2,则M为Fe,
(1)C、N、O、F四种元素第一电离,非金属性越强,其第一电离能越大,但是由于N元素的p轨道处于半充满状态,故N的第一电离能大于O,故第一电离能由大到小的顺序为:F>N>O>C,
故答案为:F>N>O>C;
(2)M为Fe元素,其原子序数为26,其基态原子核外电子排布式为:1s22s22p63s23p63d64s2或[Ar]3d64s2,
故答案为:1s22s22p63s23p63d64s2或[Ar]3d64s2;
(3)W为C、X为O元素,W与X两元素组成的最简单二价阴离子为CO32-,CO32-的中C原子价层电子对数=3+$\frac{4+2-2×3}{2}$=3,所以C原子采取sp2杂化,C原子没有最外层不存在未成键电子对,所以CO32-的空间构型为平面三角形,
故答案为:平面三角形;sp2杂化;
(4)Y与T、X、Z、W所形成的最简单化合物分别为HF、H2O、NH3、CH4,由于HF、H2O、NH3中存在氢键,所以CH4的沸点最低;常温下水为气态,氟化氢和氨气为气态,则水的沸点最高;标况下氟化氢为液态,氨气为气态,则HF的沸点大于氨气,所以四种气体的沸点大小为:H2O>HF>NH3>CH4,
故答案为:H2O>HF>NH3>CH4.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度中等,推断各元素为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力.

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案| A. | 太阳能发电 | B. | 火力发电 | C. | 推广节能灯 | D. | 发展核电 |
| A. | 甲烷与氯气混合光照反应后所得产物为4种 | |
| B. | 乙醇燃烧生成二氧化碳和水,说明乙醇具有氧化性 | |
| C. | 通入适量的H2可以除去乙烷中混有的乙烯杂质 | |
| D. | 制备乙酸乙酯可用饱和碳酸钠溶液收集 |
| A. | 糖类、油脂和蛋白质都是人体必需的营养物质,都属于高分子化合物 | |
| B. | 除去乙醇中少量的乙酸:加入足量生石灰,蒸馏 | |
| C. | 乙醇和苯都不能使溴的四氯化碳溶液和酸性KMnO4溶液褪色 | |
| D. | 石油裂化的主要产品是甲烷、乙烯和苯 |
| A. | AlCl3与氨水 | B. | 铁与稀硝酸 | C. | HCl与Na2CO3 | D. | NaHCO3与Ca(OH)2 |
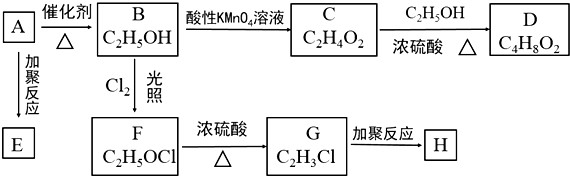
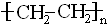 ;
; CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.