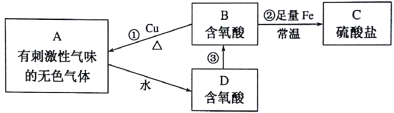
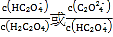题目内容
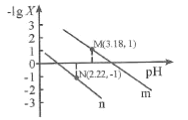
【题目】室温下,将1.000mol/L盐酸滴入20.00mL1.000mol/L氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是( )
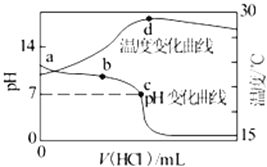
A.a点由水电离出的c(H+)=1.0×10-14mol/L
B.b点时c(NH4+)+c(NH3·H2O)>c(Cl-)
C.c点时消耗的盐酸体积:V(HCl)=20.00mL
D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
【答案】B
【解析】
A.因a点7<pH<14,因此水电离出的c(H+)>1.0×1014mol·L1,故A错误;
B.盐酸和氨水反应,溶液呈中性,则c(H+)=c(OH-),根据电荷守恒可知c(Cl-)=c(NH4+),b点时pH>7,则氨水过量,c(NH4+)+c(NH3·H2O)>c(Cl-),故B正确;
C.C点溶液呈中性,则c(H+)=c(OH-),氯化铵是强酸弱碱盐,其水溶液呈酸性,要使其水溶液呈中性,则氨水应该稍微过量,所以消耗盐酸的体积V(HCl)<20.00mL,故C错误;
D.d点时盐酸和氨水恰好完全反应,放热最多,再加盐酸温度降低只能是加入盐酸的温度低于溶液温度,这才是温度下降的原因,故D错误。
综上所述,答案为B。

【题目】酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-38 |
回答下列问题:
(1)该电池的正极反应式为___,电池反应的离子方程式为:___。
(2)维持电流强度为0.5A,电池工作十分钟,理论上消耗Zn___g。(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过__分离回收;滤渣的主要成分是MnO2、___和___,欲从中得到较纯的MnO2,最简便的方法是在空气中加热,其原理是___。
(4)用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,铁变为__,加碱调节至pH为__时,铁刚好完全沉淀;继续加碱调节至pH为___时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果是___,原因是__。