题目内容
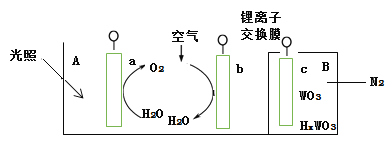
【题目】PCl3主要用于制造敌百虫等有机磷农药和磺胺嘧啶(S.D)等医药的原料。如图为实验室中制取粗PCl3产品的装置,夹持装置略去。
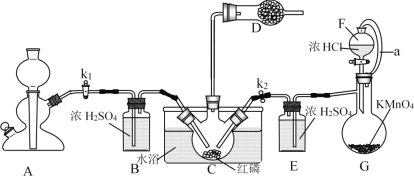
经查阅资料知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇水会强烈水解生成H3PO3。PCl3遇O2会生成POCl3(三氯氧磷),PCl3、POCl3的熔沸点见下表。
物质 | 熔点/℃ | 沸点/℃ |
PCl3 | -112 | 75.5 |
POCl3 | 2 | 105.3 |
回答下列问题:
(1)仪器G的名称是______。装置F与G由橡胶管a相连通,a的作用是_______。
(2)A是制取CO2装置,CO2的作用是_____,选择A中的药品是_____(填字母)。
a.稀盐酸 b.稀硫酸 c.NaHCO3粉末 d.块状石灰石
(3)装置D中盛有碱石灰,其作用是__________________。
(4)装置G中生成Cl2,反应的离子方程式为___________。
(5)装置C采用65-70℃水浴加热,制得的PCl3粗产品中常含有POCl3、PCl5等杂质,除杂的方法是:先加入红磷加热,除去PCl5,然后通过___________(填实验操作名称),即可得到较纯净的PCl3。
(6)通过实验测定粗产品中PCl3的质量分数,实验步骤如下(不考虑杂质的反应):
第一步:迅速移取20.0 g PCl3粗产品,加水完全水解后,再配成500mL溶液;
第二步:移取25.00mL溶液置于锥形瓶中;
第三步:加入0. 5molL-1碘溶液20mL,碘过量,H3PO3完全反应生成H3PO4;
第四步:加入几滴淀粉溶液,用1.0 molL-1Na2S2O3标准溶液滴定过量的碘,反应方程式为I2+2Na2S2O3=Na2S4O6+2NaI,滴至终点时消耗Na2S2O3标准溶液12mL。
①第三步中反应的化学方程式为_____________。
②根据上述数据,计算该产品中PCl3的质量分数为______%。
【答案】蒸馏烧瓶 使F与G压强相同,便于浓盐酸容易滴出 赶尽装置中空气,防止PCl3被氧化 ad 防止空气中水蒸气进入装置使PCl3水解,吸收未反应的氯气,防止污染空气 16H+ +10Cl-+2MnO4-=5Cl2↑+2Mn2++8H2O 蒸馏 H3PO3+H2O+I2=H3PO4+2HI 55
【解析】
首先A中利用稀盐酸和块状石灰石制取CO2,生成的CO2经过B获得干燥的CO2,CO2气流就会排尽装置内部的空气,以避免生成的PCl3被氧化,然后G中盐酸和高锰酸钾反应制取氯气,经过E中浓硫酸干燥获得干燥的氯气,并与C中红磷反应获得PCl3,另外D中碱石灰吸收空气中的水蒸气和吸收未反应的氯气。
(1)观察仪器G的结构特点知仪器G的名称是蒸馏烧瓶;装置F与G由橡胶管a相连通,a的作用是平衡F和G内部气体的压强,便于浓盐酸在重力作用下更容易滴出,即使F与G压强相同,便于浓盐酸容易滴出;
(2) PCl3遇O2会生成POCl3(三氯氧磷),所以需要排尽装置内部的空气,故A中制取CO2的作用是赶尽装置中空气,防止PCl3被氧化;NaHCO3粉末和酸反应生成CO2的速率过快,不易控制,因而选用块状石灰石与酸反应,而稀硫酸与石灰石反应生成微溶的硫酸钙,其附着在石灰石表面,阻碍反应进行,所以选用块状石灰石与稀盐酸反应制取CO2,故选ad;
(3) PCl3遇水会强烈水解生成H3PO3,同时氯气有剧毒,易与碱反应,因而装置D中盛有碱石灰的作用是防止空气中水蒸气进入装置使PCl3水解,吸收未反应的氯气,防止污染空气;
(4) 装置G中高锰酸钾将盐酸氧化得到氯气,其离子方程式为16H+ +10Cl-+2MnO4-=5Cl2↑+2Mn2++8H2O;
(5) 先加入红磷加热,除去PCl5,此时的杂质为POCl3,观察题给表格信息,PCl5和POCl3沸点相差30℃以上,然后通过蒸馏即可除去POCl3,即可得到较纯净的PCl3;
(6)①加入碘溶液,H3PO3完全反应生成H3PO4,P元素化合价由+3变为+5,H3PO3作还原剂,碘作氧化剂,被还原成HI,所以反应的化学方程式为H3PO3+H2O+I2=H3PO4+2HI;
②滴定剩余的I2消耗Na2S2O3物质的量为1.0×12×10-3mol=0.012mol,由I2+2Na2S2O3=Na2S4O6+2NaI,剩余的I2为![]() ×0.012mol=0.006mol,所以与H3PO3反应的I2为0.5×20×10-3mol-0.006mol=0.004mol,根据关系式PCl3~ H3PO3~ I2可知,20.0g产品中PCl3的质量为
×0.012mol=0.006mol,所以与H3PO3反应的I2为0.5×20×10-3mol-0.006mol=0.004mol,根据关系式PCl3~ H3PO3~ I2可知,20.0g产品中PCl3的质量为![]() g=11g,PCl3的质量分数为
g=11g,PCl3的质量分数为![]() ×100%=55%。
×100%=55%。

 阅读快车系列答案
阅读快车系列答案【题目】如图是元素周期表的一部分,按要求回答问题:
① |
| ||||||||||||||||
|
|
| ② | ③ | ④ |
|
| ||||||||||
⑤ | ⑥ |
|
|
|
|
|
|
|
|
|
| ⑦ |
|
| ⑧ | ⑨ |
|
(1)元素④在周期表中位置是_______。元素③的最高价氧化物的化学式为________。
(2)元素①⑤组成化合物电子式为___________。
(3)元素②的单质与⑧的最高价氧化物的水化物热的浓溶液反应的化学方程式为___。
(4)元素⑦与⑨形成的化合物与元素③的氢化物的水溶液反应的离子方程式为_____。
(5)元素④⑤⑥⑧形成的简单离子,其离子半径由小到大的顺序为_____(用离子符号表示)。
(6)A—F发生如图所示的转化,A、B、C、D为①—⑨中某种元素形成的单质,E、F、G为B、C、D与A形成的二元化合物,G是一种常见温室气体,与B可以反应生成E,E中B元素的质量分数为60%,F为两性物质。

①A和F的化学式分别为_______、_______。
②B与G反应的化学方程式为____________________。
③C与NaOH溶液反应的离子方程式为______________。