题目内容
化学是一门以实验为基础的自然科学,根据已有实验知识回答下列问题。
(1)下列说法错误的 。
A.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
B.将Cl2通入紫色石蕊试液,溶液先变红后褪色
C.配制1L0.5mol·L-1的NaCl溶液,需用托盘天秤称量29.25gNaCl固体
D.常温下,可以用铁质容器储运浓硝酸
E.实验室保存硫酸亚铁溶液,需在试剂瓶内加入铁粉或铁钉,防止硫酸亚铁被氧化
F.实验室可以用加热氯化铵的方法制取少量氨气
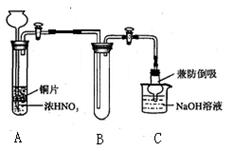
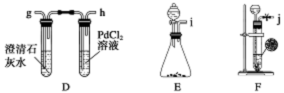
(2)已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用如图所示的装置进行实验。实验过程中需从导管a处缓缓鼓入一定量的空气。
①装置E的名称 ,试剂b为 。
②实验过程中需要测定的数据除样品质量外有: (填序号)。
A.反应前后装置C的质量 B.反应前后装置D的质量 C.反应前后装置E的质量
③若去掉装置A,则测定结果 (填“偏高”“偏低”或“无影响”)。
(1)C F (2)①干燥管 碱石灰 ② B ③ 偏高
解析试题分析:(1)A符合分液漏斗中液体放出的规则。正确。B. Cl2溶于水发生反应:Cl2+H2O HCl+HClO。产生的HCl和HClO都是酸,能使紫色石蕊试液变为红色,但由于HClO有强的氧化性,又会把红色氧化物无色。故将Cl2通入紫色石蕊试液,溶液先变红后褪色。正确。C.托盘天秤的准确度为0.1g,所以称量质量为29.3gNaCl固体.错误。D.在常温下,Fe遇到浓硫酸会被氧化产生一薄层致密的氧化物保护膜而阻止了金属继续被硝酸氧化。因此可以用铁质容器储运浓硝酸。正确。E.在常温下Fe2+容易被空气中的氧气氧化为Fe3+,如果变质,在实验室保存硫酸亚铁溶液时向溶液中加入铁粉或铁钉,就会发生反应:2Fe3++Fe="=" 3Fe2+,从而起到防止硫酸亚铁被氧化的作用。正确。F.NH4Cl
HCl+HClO。产生的HCl和HClO都是酸,能使紫色石蕊试液变为红色,但由于HClO有强的氧化性,又会把红色氧化物无色。故将Cl2通入紫色石蕊试液,溶液先变红后褪色。正确。C.托盘天秤的准确度为0.1g,所以称量质量为29.3gNaCl固体.错误。D.在常温下,Fe遇到浓硫酸会被氧化产生一薄层致密的氧化物保护膜而阻止了金属继续被硝酸氧化。因此可以用铁质容器储运浓硝酸。正确。E.在常温下Fe2+容易被空气中的氧气氧化为Fe3+,如果变质,在实验室保存硫酸亚铁溶液时向溶液中加入铁粉或铁钉,就会发生反应:2Fe3++Fe="=" 3Fe2+,从而起到防止硫酸亚铁被氧化的作用。正确。F.NH4Cl NH3+HCl.在试管口再发生反应: NH3+HCl= NH4Cl。因而不能用加热氯化铵的方法制取少量氨气。错误。选项为C F。(2)①装置E的名称为干燥管;在装置DE中盛装的为能够吸收二氧化碳气体的干燥剂碱石灰。②为测定试样中纯碱的质量分数只需要测定装置D在吸收二氧化碳气体前后的质量即可。故选项为B。③由于空气中也含有少量的二氧化碳气体,所以若去掉装置A,就会使一部分空气中的二氧化碳气体被当作为样品反应产生的产物而吸收,所以最终使测定结果偏高。
NH3+HCl.在试管口再发生反应: NH3+HCl= NH4Cl。因而不能用加热氯化铵的方法制取少量氨气。错误。选项为C F。(2)①装置E的名称为干燥管;在装置DE中盛装的为能够吸收二氧化碳气体的干燥剂碱石灰。②为测定试样中纯碱的质量分数只需要测定装置D在吸收二氧化碳气体前后的质量即可。故选项为B。③由于空气中也含有少量的二氧化碳气体,所以若去掉装置A,就会使一部分空气中的二氧化碳气体被当作为样品反应产生的产物而吸收,所以最终使测定结果偏高。
考点:考查物质纯度的测定及分液、称量、物质的保存、气体的制备等知识。

某矿样含有大量的CuS、少量铁的氧化物及少量其他不溶于酸的杂质。某化学课外小组设计以下流程,以该矿样为原料生产CuCl2·2H2O晶体。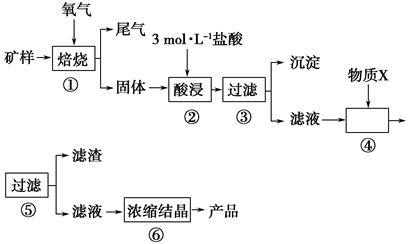
已知:在20 ℃时,氯化铜的溶解度是73 g;常温下,金属离子开始沉淀和沉淀完全时的pH见下表。
| 金属离子 | 开始形成氢氧化物沉淀的pH | 完全形成氢氧化物沉淀的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
回答下列问题:
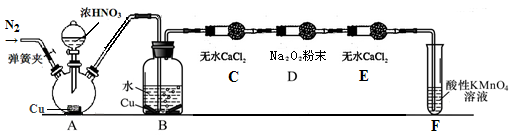
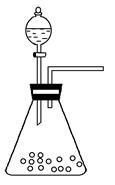
(1)步骤①的焙烧过程中需要通入氧气。在实验室中使用中学化学常见物质,用如图所示装置制取氧气,试写出你熟悉的、符合上述条件的两个化学方程式:______________________、________________________;
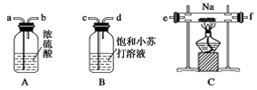
(2)在焙烧过程中还有废气产生,其中一种是主要的大气污染物。若在实验室中用碱液吸收处理,下列A、B、C装置中可行的是________(填字母);若选用甲装置,则烧杯中的下层液体可以是________。
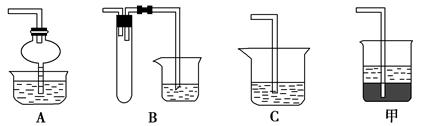
(3)步骤②酸浸过程中,需要用到3 mol·L-1的盐酸100 mL,配制该盐酸时。除了用到烧杯、玻璃棒、胶头滴管外,还需要用到的仪器有________________。
(4)步骤④加入物质X的目的是________________________________,物质X可以选用下列物质中的________。
A.氧化铜 B.稀盐酸
C.氨水 D.氧化亚铁
(5)在整个生产流程中,共需要进行________次过滤操作。
(15分)硬质玻璃管是化学实验中经常使用的一种仪器,请分析下列实验(固定装置略)并回答问题。
Ⅰ、进行微量实验:如图所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表。请填写表中的空白: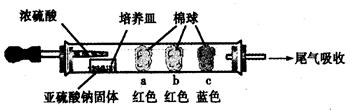
| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | | 棉球变白,微热后又恢复红色 | |
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式: |
| c | | 棉球变为白色 | 该气体具有 (选填“氧化性”或“还原性”) |
Ⅱ、硬质玻璃管与其它装置结合完成定性或定量实验。下图是某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究的装置。
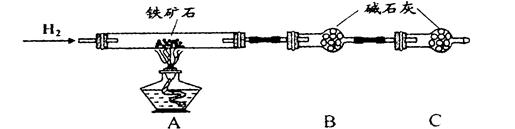
实验一:铁矿石中含氧量的测定
(1)按上图组装仪器(夹持仪器均省略),检查装置的气密性;
(2)将10.0g铁矿石放入硬质玻璃管中;
(3)从左端导气管口处不断地缓缓通入H2, 后,点燃A处酒精灯;
(4)充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(5)测得反应后装置B增重2.70g,则铁矿石中氧的质量分数为______________________。
实验二:铁矿石中含铁量的测定
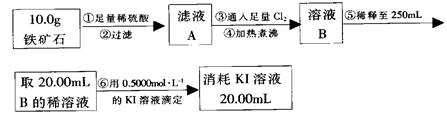
(1)步骤②和⑤中都要用到的玻璃仪器是 __。
(2)下列有关步骤⑥的操作中说法不正确的是_______。
a.滴定管用蒸馏水洗涤后再用待装液润洗
b.锥形瓶需要用待测液润洗
c.因为碘水为黄色,所以滴定过程中不需加指示剂
实验结论:推算铁的氧化物的组成,由实验一、二得出该铁矿石中铁的氧化物的化学式为