题目内容
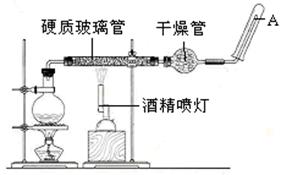
某化学兴趣小组的学生从网上查得如下信息:①钠能在CO2中燃烧。②常温下CO能与PdCl2溶液反应得到黑色的Pd。经过分析讨论,他们认为钠在CO2中燃烧时,还原产物可能是碳,也可能是CO,氧化产物可能是Na2CO3。为验证上述推断,他们设计如下方案进行实验,请回答下列问题。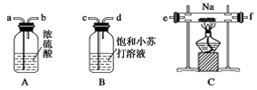
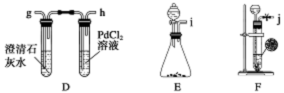
(1)他们欲用上述装置组装一套新装置:用石灰石与盐酸反应制取CO2(能随意控制反应的进行)来证明钠能在CO2中燃烧并检验其还原产物,所用装置接口连接顺序为_________。
(2)若装置D的PdCl2溶液中有黑色沉淀,C中有残留固体(只有一种物质),则C中反应的化学方程式为________________________________________________________;
若装置D的PdCl2溶液中无黑色沉淀,C中有残留固体(有两种物质),则C中反应的化学方程式为___________________________________________________________。
(3)后来有一位同学提出,钠的氧化产物也可能是Na2O,因此要最终确定钠的氧化产物是何种物质,还需要检验C中残留的固体是否含有Na2O,为此,他认为应较长时间通入CO2以确保钠反应完,然后按照如下方案进行实验,可确定残留固体中是否含有Na2O,他的实验方案是_________________________________________________________。
(1)jcdabefg(e与f可颠倒)
(2)2Na+2CO2 Na2CO3+CO 4Na+3CO2
Na2CO3+CO 4Na+3CO2 2Na2CO3+C
2Na2CO3+C
(3)将残留固体溶于水,在所得水溶液中加入过量BaCl2溶液,再向溶液中滴加2滴酚酞试液,若溶液变红色,则残留固体中含有Na2O,否则不含Na2O(其他合理答案也可)
解析试题分析:(1)首先用F装置制取CO2,然后通入B,饱和碳酸氢钠除去HCl杂质,再通入A,浓硫酸干燥,通入C,与Na反应,最后通入D,检验产物,所以接口顺序为:jcdabefg。
(2)PdCl2溶液中有黑色沉淀,说明生成了CO,化学方程式为:2Na+2CO2 Na2CO3+CO;装置D的PdCl2溶液中无黑色沉淀,C中有残留固体(有两种物质),说明生成了C,化学方程式为:4Na+3CO2
Na2CO3+CO;装置D的PdCl2溶液中无黑色沉淀,C中有残留固体(有两种物质),说明生成了C,化学方程式为:4Na+3CO2 2Na2CO3+C。
2Na2CO3+C。
(3)检验是否含有Na2O,应首先除去Na2CO3,加入过量的BaCl2溶液可除去Na2CO3,利用Na2O与水反应生成NaOH,使溶液显碱性进行检验,向溶液中滴加2滴酚酞试液,若溶液变红色,则残留固体中含有Na2O,否则不含Na2O。
考点:本题考查仪器的连接、化学方程式的书写、物质的检验。

某化学小组在学习元素周期律后,对教材中Fe2+氧化为Fe3+的实验进一步思考,并提出问题:Cl2能将Fe2+氧化为Fe3+,那么Br2和I2能否将Fe2+氧化为Fe3+?
环节一:理论推测
部分同学认为Br2和I2都可能将Fe2+氧化为Fe3+,他们思考的依据是 。
部分同学认为Br2和I2都不能将Fe2+氧化为Fe3+,还有同学认为Br2能将Fe2+氧化为Fe3+而I2不能。他们思考的依据是从上到下卤素单质氧化性减弱。
环节二:设计实验进行验证
在大试管中加适量铁粉,加入10 mL稀盐酸,振荡试管,充分反应后,铁粉有剩余,取上层清液进行下列实验。
实验1:
| 试管 | 操作 | 现象 |
| ① | 先向试管中加入2 mL FeCl2溶液,再滴加少量红棕色的溴水,振荡试管 | 溶液为黄色 |
| ② | 先向试管中加入2 mL FeCl2溶液,再滴加少量棕黄色的碘水,振荡试管 | 溶液为黄色 |
(1)同学甲认为①中现象说明溴水能将Fe2+氧化,离子方程式为 。
同学乙认为应该补充实验,才能得出同学甲的结论。请你帮助同学乙完成实验:
实验2:
| 操作 | 应该观察到的现象 |
| | |
(2)该小组同学对②中溶液呈黄色的原因展开了讨论:
可能1:碘水与FeCl2溶液不反应,黄色是碘水稀释后的颜色。
可能2: 。
实验3:进行实验以确定可能的原因。
| 操作 | 现象 |
| 向试管②所得溶液中继续加入0.5 mL CCl4,充分振荡,静置一段时间后。取出上层溶液,滴加KSCN溶液 | 静置后,上层溶液几乎无色,下层溶液为紫色;上层溶液滴加KSCN溶液后,出现浅红色 |
同学丙认为该实验现象可以说明是“可能2”成立,同学丁认为不严谨,于是设计了实验4:
实验4:
| 操作 | 现象 |
| 向另一支试管中加入2 mL FeCl2溶液,滴加0.5 mL碘水后,再加入0.5 mL乙酸乙酯,充分振荡,静置一段时间后。取出下层溶液,滴加KSCN溶液 | 静置后,上层液为紫色,下层液几乎无色;下层溶液滴加KSCN溶液后,没有出现浅红色 |
你认为实验4设计的主要目的是 。
同学丁根据实验4现象得出结论:在本次实验条件下,碘水与FeCl2溶液反应的程度很小。
(3)Cl2、Br2、I2氧化Fe2+的能力逐渐减弱,用原子结构解释原因: 。
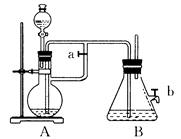
(12分)某兴趣小组研究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示: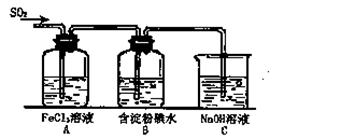
(1)SO2气体与Fe3+反应的主要产物是__ __ 。(填离子符号)
(2)下列实验方案可以用于在实验室制取所需SO2的是 。
| A.Na2SO3溶液与HNO3 | B.Na2SO3固体与浓硫酸 |
| C.固体硫在纯氧中燃烧 | D.铜与热浓H2SO4 |
(4)如果有280mL SO2气体(已折算为标态)进入C装置中,则C中50mL NaOH溶液的物质的量浓度至少为 mol/L才能达到目的。
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案②:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是 ,原因是 。
(6)能表明I—的还原性弱于SO2的现象是 ,写出有关离子方程式: 。
碘在地壳中主要以NaIO3的形式存在,在海水中主要以 的形式存在,几种粒子之间有如图所示关系,根据图示转化关系推测下列说法不正确的是
的形式存在,几种粒子之间有如图所示关系,根据图示转化关系推测下列说法不正确的是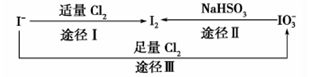
| A.可用KI淀粉试纸和食醋检验加碘盐中是否含有碘 |
B.足量Cl2能使湿润的KI淀粉试纸变白的原因可能是 |
C.由图可知氧化性的强弱顺序为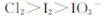 |
D.途径Ⅱ中若生成1molI2,反应中转移的电子数为10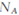 |

 被还原成Mn2+。向反应后的溶液中加入适量锌粉,至黄色刚好消失,所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
被还原成Mn2+。向反应后的溶液中加入适量锌粉,至黄色刚好消失,所得溶液收集到锥形瓶中,此时溶液仍呈酸性。