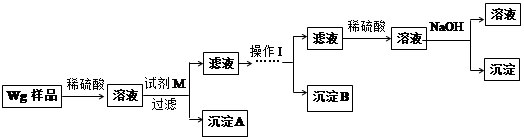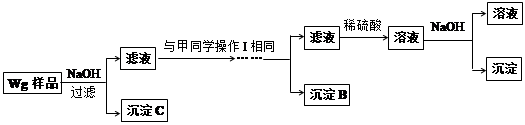题目内容
某氯化亚铁和氯化铁的混合物。现要测定其中铁元素的质量分数,进行如下实验:
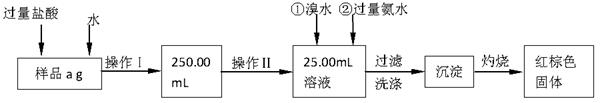
Ⅰ.甲同学根据如下流程进行实验,回答以下问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 (填仪器名称)
(2)请写出加入溴水发生的离子反应方程式 。
(3)将沉淀物置于坩埚中加热至恒重后,冷却至室温,称量剩余固体和坩埚的质量,计算。
实验中加热至恒重的目的是 。
(4)若坩埚质量是W1g,坩埚与加热后固体总质量是W2g,则样品中铁元素的质量分数是 。
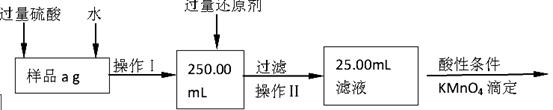
Ⅱ.乙同学提出,还可以采用以下方法来测定:
(1)溶解样品改用了硫酸,用离子方程式指明不再用盐酸原因是 ;
(2)若要用实验证明操作Ⅱ所得滤液中不存在Fe3+,其最可靠的化学方法是 ;
(3)若滴定用掉c mol/L KMn04溶液b mL,则样品中铁元素的质量分数是 。
Ⅰ.(1)250mL容量瓶(1分)、胶头滴管(1分)
(2)2Fe2++Br2=2Fe3++2Br-(2分)
(3)使Fe(OH)3分解完全(2分)
(4)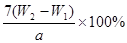 (2分)
(2分)
Ⅱ.(1)2MnO4- +16H+ +10Cl- =2Mn2+ +5Cl2 +8H2O(2分)
(2)取少量滤液于试管中,滴加1~2滴KSCN溶液,溶液不变红(2分)
(3)2.8bc/a(2分)
解析试题分析:Ⅰ.(1)配制一定物质的量浓度的溶液所需要的仪器有:胶头滴管、烧杯、玻璃棒、一定规格的容量瓶,所以还缺:250mL容量瓶、胶头滴管。
(2)加入溴水后溴单质氧化亚铁离子,反应的离子方程式为:2Fe2+Br2=2Fe3++2Br-。
(3)加热至恒重,说明Fe(OH)3分解完全。
(4)坩埚质量是W1g,坩埚与加热后固体总质量是W2g,则生成的氧化铁质量为(W2-W1)g,25ml溶液中铁元素的质量=112/160(W2-W1)g,250ml中含有铁元素质量10×112/160(W2-W1)g,所以铁元素质量分数=×100%=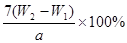
Ⅱ.(1)MnO4?能把Cl?氧化为Cl2,离子方程式为:2MnO4- +16H+ +10Cl- =2Mn2+ +5Cl2 +8H2O
(2)检验不存在Fe3+,应使用KSCN溶液,所以方法是:取少量滤液于试管中,滴加1~2滴KSCN溶液,溶液不变红。
(3)根据MnO4?氧化Fe2+的离子方程式:5Fe2++MnO4-+16H+=Mn2++5Fe3++8H2O,25.00mL溶液含 n(Fe2+)=5n(MnO4?)=5bc×10-3mol,则250ml溶液中含铁元素物质的量为5bc×10-2mol,所以样品中铁元素的质量分数=5bc×10-2mol×56g/mol÷ag=2.8bc/a 。
考点:本题考查探究实验设计和实验操作应用、溶液配制、氧化还原滴定的应用及计算。

我国化工专家侯德榜发明的侯氏制碱法的化学原理是将二氧化碳通入氨水的氯化钠饱和溶液中,其化学反应方程式为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。
(1)在实验室中利用上述原理从反应所得溶液中分离出碳酸氢钠晶体,应选用下列装置中的 。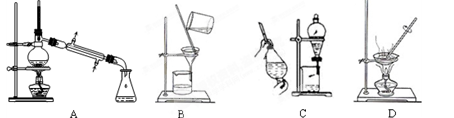
(2)实验所得碳酸氢钠晶体中,可能含有的杂质离子有Cl—和NH4+,实验室鉴定Cl—所选用的试剂是、,鉴定另一种杂质离子的方法是 (填序号)。
| A.加水,将湿润的红色石蕊试纸放在试管口 |
| B.加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口 |
| C.加氢氧化钠溶液,加热,滴入酚酞试剂 |
| D.加氢氧化钠溶液,加热,滴入紫色石蕊试剂 |

 、
、 
 样品含有少量
样品含有少量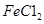 杂质。现要测定其中
杂质。现要测定其中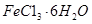 的质量分数,实验按以下步骤进行:
的质量分数,实验按以下步骤进行: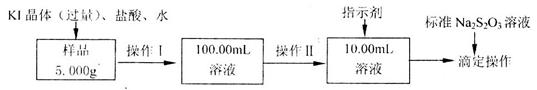
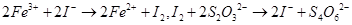
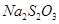 溶液18.00mL。该样品中
溶液18.00mL。该样品中