题目内容
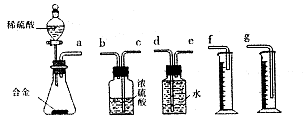
(15分)硬质玻璃管是化学实验中经常使用的一种仪器,请分析下列实验(固定装置略)并回答问题。
Ⅰ、进行微量实验:如图所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表。请填写表中的空白: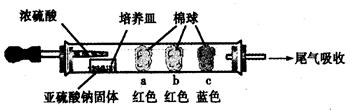
| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | | 棉球变白,微热后又恢复红色 | |
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式: |
| c | | 棉球变为白色 | 该气体具有 (选填“氧化性”或“还原性”) |
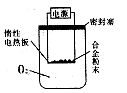
Ⅱ、硬质玻璃管与其它装置结合完成定性或定量实验。下图是某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究的装置。
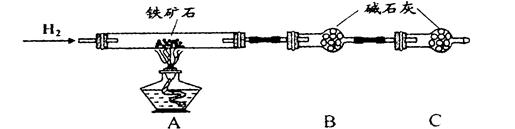
实验一:铁矿石中含氧量的测定
(1)按上图组装仪器(夹持仪器均省略),检查装置的气密性;
(2)将10.0g铁矿石放入硬质玻璃管中;
(3)从左端导气管口处不断地缓缓通入H2, 后,点燃A处酒精灯;
(4)充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(5)测得反应后装置B增重2.70g,则铁矿石中氧的质量分数为______________________。
实验二:铁矿石中含铁量的测定
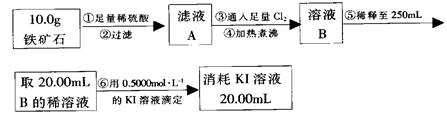
(1)步骤②和⑤中都要用到的玻璃仪器是 __。
(2)下列有关步骤⑥的操作中说法不正确的是_______。
a.滴定管用蒸馏水洗涤后再用待装液润洗
b.锥形瓶需要用待测液润洗
c.因为碘水为黄色,所以滴定过程中不需加指示剂
实验结论:推算铁的氧化物的组成,由实验一、二得出该铁矿石中铁的氧化物的化学式为
Ⅰ
Ⅱ、实验一:(3)在C装置出口处收集H2并验纯后(2分) (5)24%(2分)棉球 棉球上滴加的试剂 现象 解释和结论 a 品红试液 SO2具有漂白性,且为暂时性漂白 b 离子方程式:2OHˉ+ SO2 = SO32ˉ+ H2O 或OHˉ+SO2=HSO3ˉ c 含淀粉的碘水 还原 性
实验二:(1))烧杯、玻璃棒(2分)(2)bc(2分)
实验结论: Fe5O6(2分)
解析试题分析:Ⅰ、a、品红试液是红色的,二氧化硫能使品红褪色,漂白原理是:SO2与品红反应生成无色不稳定物质,遇热分解又生成SO2和品红,又恢复红色;
b、氢氧化钠遇到酚酞也是红色的,二氧化硫能和氢氧化钠反应导致红色消失,反应原理是:SO2+OH-=HSO3-;
c、碘单质遇到淀粉变为蓝色,二氧化硫能将碘单质还原为碘离子,SO2+I2+2H2O=H2SO4+2HI,从而使蓝色消失;
Ⅱ、实验一:(1)(2)测的反应后装置B增重2.70g,根据反应的实质,增加的是氧元素的质量,所以氧元素的质量分数是: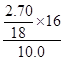 ×100%=24%,
×100%=24%,
故答案为:24%;
实验二:(2)a、滴定管用蒸馏水洗涤后必须用标准液润洗,故a错误;
b、锥形瓶不需要用待测液润洗,故b错误;
c、碘水为黄色,三价铁离子也是黄色溶液,滴定过程中需加指示剂,故c正确;
由实验一,n(H2O)=2.7g/18g/mol=0.15mol
H2 ~ H2O ~ O
0.15mol 0.15mol
由实验二, 2Fe3++2I-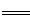 2Fe2++I2 Fe3+ ~ I-
2Fe2++I2 Fe3+ ~ I-
0.5×0.02 0.5×0.02
n(Fe3+)=0.5mol/L×0.25L=0.125mol
Fe3+ ~ Fe
0.125mol 0.125mol
所以n(Fe):n(O)=0.125mol:0.15mol=5:6
考点:考查探究物质的组成或测量物质的含量。

 阅读快车系列答案
阅读快车系列答案铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用.
(一)用铁屑与硫酸反应制备FeSO4
已知4Fe2++O2+4H+= 4Fe3++2H2O。FeSO4在水中的溶解度见图。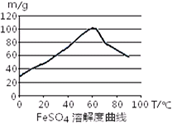
(1)首先,将铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。此步骤中,分离出液体的方法通常不用过滤,使用的操作是____________(填写操作名称)。
(2)向处理过的铁屑中加入适量的硫酸,在一定温度下使其反应到不再产生气体,趁热过滤,得FeSO4溶液。此处:硫酸浓度应选择
| A.浓硫酸 | B.10moL/L硫酸 | C.3moL/L硫酸 | D.任意浓度硫酸; |
(3)亚铁盐在空气中易被氧化,但形成复盐可稳定存在。如“摩尔盐”,即硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O],就是在FeSO4溶液中加入少量稀H2SO4溶液,再加入饱和(NH4)2SO4溶液,经过蒸发浓缩、冷却结晶、过滤等一系列操作后所得。过程中稀硫酸的作用是 。
(二)用含有少量Al的废铁屑制备Fe2(SO4)3其操作流程及有关资料如下:
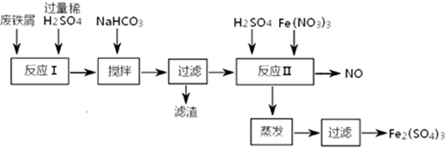
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(4)加NaHCO3时,混合液pH值应控制在_______________________。
(5)反应Ⅱ中反应的离子方程式是:___________________。
(6)实际生产中,将反应Ⅱ产生的NO配比一种气体X,混合后重新通入反应Ⅱ中,该设计的目的是________,气体X与NO配比的比例是_____________。
FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业生产流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下: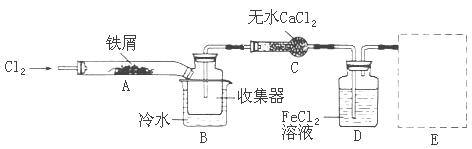
①检查装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成
④ ……
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封
请回答下列问题:
(1)写出FeCl3溶液吸收有毒的H2S的离子方程式为
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A的右端。要使沉积得FeCl3进入收集器,第④步操作是
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)
(4)装置B中的冷水作用为 ;装置C的名称为 ;装置D中FeCl2全部反应完后,因为失去吸收Cl2的作用而失效,从下面选出检验FeCl2是否完全失效的试剂:___
| A.氢氧化钠溶液 | B.酸性高锰酸钾溶液 | C.硫氰化钾溶液 | D.氨水 |
(12分)某兴趣小组研究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示: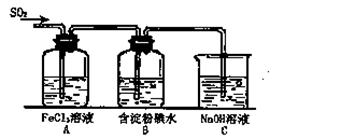
(1)SO2气体与Fe3+反应的主要产物是__ __ 。(填离子符号)
(2)下列实验方案可以用于在实验室制取所需SO2的是 。
| A.Na2SO3溶液与HNO3 | B.Na2SO3固体与浓硫酸 |
| C.固体硫在纯氧中燃烧 | D.铜与热浓H2SO4 |
(4)如果有280mL SO2气体(已折算为标态)进入C装置中,则C中50mL NaOH溶液的物质的量浓度至少为 mol/L才能达到目的。
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案②:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是 ,原因是 。
(6)能表明I—的还原性弱于SO2的现象是 ,写出有关离子方程式: 。


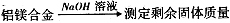 。
。
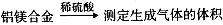 。
。