题目内容
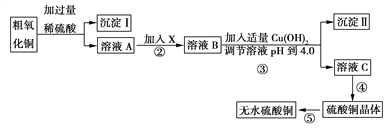
【题目】某化学活动小组按下图所示流程由粗氧化铜样品(含少量氧化亚铁及不溶于酸的杂质)制取无水硫酸铜。
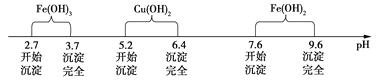
已知Fe3+、Cu2+、Fe2+三种离子在水溶液中形成氢氧化物沉淀的pH范围如下图所示:
请回答下列问题:
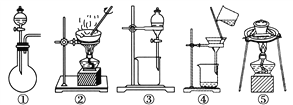
(1)在整个实验过程中,下列实验装置不可能用到的是________(填序号)。
(2)溶液A中所含溶质为________;物质X应选用________(填序号)。
①氯水 ②双氧水 ③铁粉 ④高锰酸钾
(3)从溶液C中制取硫酸铜晶体的实验操作为______________________________。
(4)用“间接碘量法”可以测定溶液A(不含能与I-发生反应的杂质)中Cu2+的浓度。过程如下:
第一步:移取10.00 mL溶液A于100 mL容量瓶中,加水定容至100 mL。
第二步:取稀释后溶液20.00 mL于锥形瓶中,加入过量KI固体,充分反应生成白色沉淀与碘单质。
第三步:以淀粉溶液为指示剂,用0.050 00 mol·L-1的Na2S2O3标准溶液滴定,前后共测定三次,达到滴定终点时,消耗Na2S2O3标准溶液的体积如下表:(已知:I2+2S2O![]() ===2I-+S4O
===2I-+S4O![]() )
)
滴定次数 | 第一次 | 第二次 | 第三次 |
滴定前读数(mL) | 0.10 | 0.36 | 1.10 |
滴定后读数(mL) | 20.12 | 20.34 | 22.12 |
①CuSO4溶液与KI的反应的离子方程式为______________________________。
②滴定中,Na2S2O3标准溶液应放在________(填“酸式滴定管”或“碱式滴定管”)中,滴定终点的现象是______________________________。
③溶液A中c(Cu2+)=________mol·L-1。
【答案】 ①③ CuSO4、FeSO4、H2SO4 ② 蒸发浓缩、冷却结晶、过滤 2Cu2++4I-===2CuI↓+I2 碱式滴定管 最后一滴标准液滴入,溶液由蓝色变为无色,振荡,半分钟内溶液无明显变化 0.5000
【解析】 (1)在整个实验过程中,实验中用到的化学操作有称量、过滤和蒸发,灼烧,没有制取气体、分液操作;正确选项①③。
(2) 氧化铜和氧化亚铁分别与硫酸反应生成硫酸铜和硫酸亚铁,又硫酸过量,则溶质A的主要成分为:CuSO4、FeSO4、H2SO4;根据实验流程可以知道,测量氧化铜含量,需要获得纯净的硫酸铜晶体,应该先除去亚杂质铁离子、铁离子,因为亚铁离子完全沉淀的pH=9.6, 此时铜离子也完全沉淀,而铁离子完全沉淀的pH=3.7, 此时铜离子没有生成沉淀,所以应该加入X将亚铁离子氧化成铁离子,并且选用的氧化剂不能引进杂质离子,不能产生污染大气的气体,所以应该选用②双氧水,符合要求;铁粉具有还原性,氯水、高锰酸钾具有氧化性,但引入新的杂质;正确答案:CuSO4、FeSO4、H2SO4 ;②。
(3)通过对硫酸铜溶液进行蒸发浓缩、冷却结晶、过滤可以得到硫酸铜晶体;正确答案:蒸发浓缩、冷却结晶、过滤。
(4)①CuSO4与KI反应生成碘单质、碘化亚铜、硫酸钾,离子反应为2Cu2++4I-=2CuI↓+I2;正确答案:2Cu2++4I-=2CuI↓+I2。
②Na2S2O3属于强碱弱酸盐,溶液呈碱性,应用碱式滴定管盛放;淀粉溶液为指示剂,当最后一滴Na2S2O3溶液滴入时,溶液蓝色褪去,半分钟颜色不变,说明滴定到达终点;正确答案:碱式滴定管 ;最后一滴标准液滴入,溶液由蓝色变为无色,振荡,半分钟内溶液无明显变化。
③三次滴定消耗的标准液的体积分别为:(20.12-0.10)mL=20.02mL、(20.34-0.36)mL=19.98mL、(22.12-1.10)mL=21.02mL,前两组数据有效,所以平均体积为:20.00mL,由2Cu2++4I-=2CuI↓+I2、I2+2S2O32-=S4O62-+2I-可知,Cu2+~S2O32-,因移取10.00mL溶液A于100mL容量瓶,加水定容至100mL,取稀释后试液20.00mL于锥形瓶中,所以c(Cu2+)=[0.05×0.02×5]/0.01=0.5000 mol/L;正确答案:0.5000。

 名题金卷系列答案
名题金卷系列答案【题目】以赤铁矿(主要成分为60.0%Fe2O3,杂质有3.6%FeO,Al2O3,MnO2,CuO等)为原料制备高活性铁单质的主要生产流程如图所示:
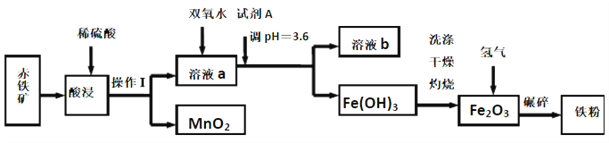
已知部分阳离子以氢氧化物形式完全沉淀时溶液的pH如表所示, 请回答下列问题:
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Cu(OH)2 |
pH | 3.4 | 5.2 | 9.7 | 6.7 |
(1)将操作Ⅰ后所得的MnO2与KClO3、KOH溶液混合共热,可得到K2MnO4,此反应的化学方程式是____________________________。
(2)将pH控制在3.6的目的是_______。已知25℃时,Ksp[Cu(OH)2]=2×10-20,该温度下反应Cu2++2H2O![]() Cu(OH)2+2H+的平衡常数K=_______。
Cu(OH)2+2H+的平衡常数K=_______。
(3)加入双氧水时反应的离子方程式为_______。
(4)利用氨气在500℃以上分解得到的氮原子渗透到铁粉中可制备氮化铁(FexNy),若消耗氨气17.0g,消耗赤铁矿石1Kg,写出该反应完整的化学方程式:_______________。