题目内容
【题目】常温下有浓度均为0.5 mol/L的四种溶液:
①Na2CO3、②NaHCO3、③HCl、④NH3·H2O
(1)上述溶液中,可发生水解的是______(填序号,下同)。
(2)上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的溶液中离子浓度由大到小的顺序为:____________________________________。
(3)向④中加入少量氯化铵固体,此时c(NH![]() )/c(OH-)的值________(填“增大”、“减小”、或“不变”)。
)/c(OH-)的值________(填“增大”、“减小”、或“不变”)。
(4)若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积________④的体积(填“大于”、“小于”或“等于”),此时溶液中离子浓度由大到小的顺序是____________。
(5)取10 mL溶液③,加水稀释到500 mL,则此时溶液中由水电离出的c(H+)=________。
【答案】 ①② c(Na+)>c(HCO![]() )>c(OH-)>c(H+)>c(CO
)>c(OH-)>c(H+)>c(CO![]() ) 增大 小于 c(NH
) 增大 小于 c(NH![]() )=c(Cl-)>c(H+)=c(OH-) 1×10-12 mol/L
)=c(Cl-)>c(H+)=c(OH-) 1×10-12 mol/L
【解析】试题分析:(1)含有弱酸阴离子或弱碱阳离子的盐能够水解,所以上述溶液中,可发生水解的是①②;
(2)弱酸的酸式盐既能与氢氧化钠反应,又能和硫酸反应,即NaHCO3溶液,碳酸氢钠溶于显碱性,溶液中离子浓度由大到小的顺序为C(Na+)>C(HCO3-)>C(OH-)>C(H+)>C(CO32-);(3)④中存在NH3·H2O![]() NH4++OH-,少量氯化铵固体,平衡逆向移动,c(NH4+)/c(OH-)增大;(4)若③④等体积混合,则恰好反应,生成强酸弱碱盐,显碱性,如果使溶液呈中性,则则混合前③的体积大于④的体积;(5)0.5 mol·L-1的HCl由10 mL稀释到500 mL,则c(H+)="0.01" mol·L-1,则此时溶液中由水电离出的c(H+)等于溶液中c(OH-)=10-12mol·L-1。
NH4++OH-,少量氯化铵固体,平衡逆向移动,c(NH4+)/c(OH-)增大;(4)若③④等体积混合,则恰好反应,生成强酸弱碱盐,显碱性,如果使溶液呈中性,则则混合前③的体积大于④的体积;(5)0.5 mol·L-1的HCl由10 mL稀释到500 mL,则c(H+)="0.01" mol·L-1,则此时溶液中由水电离出的c(H+)等于溶液中c(OH-)=10-12mol·L-1。

【题目】研究小组用下图装置制取Cl2,证明产生的气体中含有HCl。
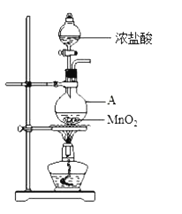
(1)仪器A的名称为________;A中反应的离子方程式为________。
(2)甲同学将A中产生的气体通入下列溶液:
实验序号 | 试剂 | 现象 |
a | 紫色石蕊溶液 | |
b | AgNO3溶液 | 出现白色沉淀 |
①实验a中的现象为________。
②不能证明产生的气体中含有HCl的实验是________(填字母序号)。
(3)已知将HCl气体通入饱和食盐水中有白色固体析出。乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但该实验不能证明气体中含有HCl,结合化学用语解释其原因:______________________________________。
(4)已知:2S2O32-+I2=== S4O62-+2I-。丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有HCl。
I.测定X中溶解的Cl2。取25.00 mL溶液X,加入过量KI溶液,然后用0.04 molL-1 Na2S2O3溶液滴定生成的I2,达滴定终点时消耗Na2S2O3溶液V mL。
II.测定X中Cl元素总量。另取25.00 mL溶液X,选用适当的还原剂将溶解的Cl2全部还原为Cl-,再用0.10 molL-1 AgNO3溶液滴定所得溶液中的Cl-。
①X中的HClO不会影响I的测定结果,原因是________。
②由I、II 中实验数据可证明A中产生的气体中含有HCl,则II中消耗0.10 molL-1 AgNO3溶液的体积应大于________mL(用含V的代数式表示)。
【题目】某化学活动小组按下图所示流程由粗氧化铜样品(含少量氧化亚铁及不溶于酸的杂质)制取无水硫酸铜。

已知Fe3+、Cu2+、Fe2+三种离子在水溶液中形成氢氧化物沉淀的pH范围如下图所示:
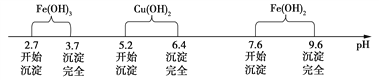
请回答下列问题:
(1)在整个实验过程中,下列实验装置不可能用到的是________(填序号)。
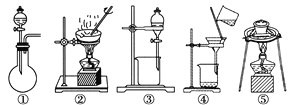
(2)溶液A中所含溶质为________;物质X应选用________(填序号)。
①氯水 ②双氧水 ③铁粉 ④高锰酸钾
(3)从溶液C中制取硫酸铜晶体的实验操作为______________________________。
(4)用“间接碘量法”可以测定溶液A(不含能与I-发生反应的杂质)中Cu2+的浓度。过程如下:
第一步:移取10.00 mL溶液A于100 mL容量瓶中,加水定容至100 mL。
第二步:取稀释后溶液20.00 mL于锥形瓶中,加入过量KI固体,充分反应生成白色沉淀与碘单质。
第三步:以淀粉溶液为指示剂,用0.050 00 mol·L-1的Na2S2O3标准溶液滴定,前后共测定三次,达到滴定终点时,消耗Na2S2O3标准溶液的体积如下表:(已知:I2+2S2O![]() ===2I-+S4O
===2I-+S4O![]() )
)
滴定次数 | 第一次 | 第二次 | 第三次 |
滴定前读数(mL) | 0.10 | 0.36 | 1.10 |
滴定后读数(mL) | 20.12 | 20.34 | 22.12 |
①CuSO4溶液与KI的反应的离子方程式为______________________________。
②滴定中,Na2S2O3标准溶液应放在________(填“酸式滴定管”或“碱式滴定管”)中,滴定终点的现象是______________________________。
③溶液A中c(Cu2+)=________mol·L-1。
【题目】对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·L-1)随时间(min)变化的有关实验数据见下表。
时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
Ⅰ(pH=2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
Ⅱ(pH=4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
Ⅳ(pH=4,含Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
下列说法不正确的是
A. 在0~20min内,I中M的分解速率为0.015 mol·L-1·min-1
p>B. 水样酸性越强,M的分解速率越快C. 在0~25min内,III中M的分解百分率比II大
D. 由于Cu2+存在,IV中M的分解速率比I快