题目内容
【题目】下列离子方程式中,只能表示一个化学反应的是( )
①Fe+Cu2+===Fe2++Cu
②Ba2++2OH-+2H++SO42—===BaSO4↓+2H2O
③Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
④CO32—+2H+===CO2↑+H2O
⑤Ag++Cl-===AgCl↓
A. 只有③ B. ②③ C. ③⑤ D. ①④
【答案】A
【解析】
试题①表示Fe和可溶性铜盐的反应,可以是CuCl2、CuSO4等,故①错误;②可以表示Ba(OH)2和H2SO4的反应,也可以不是向Ba(OH)2溶液中加入NaHSO4至溶液呈中性的反应故②错误;③只能表示氯气和水的一个化学反应,故③正确;④表示可溶性碳酸盐和强酸的反应,对应的化学反应都多种,故④错误;⑤示可溶性银盐和可溶性氯化物的反应,对应的化学反应都多种,故⑤错误;故选A。

【题目】某化学活动小组按下图所示流程由粗氧化铜样品(含少量氧化亚铁及不溶于酸的杂质)制取无水硫酸铜。

已知Fe3+、Cu2+、Fe2+三种离子在水溶液中形成氢氧化物沉淀的pH范围如下图所示:
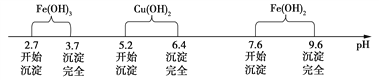
请回答下列问题:
(1)在整个实验过程中,下列实验装置不可能用到的是________(填序号)。
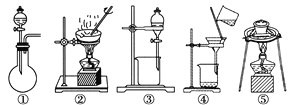
(2)溶液A中所含溶质为________;物质X应选用________(填序号)。
①氯水 ②双氧水 ③铁粉 ④高锰酸钾
(3)从溶液C中制取硫酸铜晶体的实验操作为______________________________。
(4)用“间接碘量法”可以测定溶液A(不含能与I-发生反应的杂质)中Cu2+的浓度。过程如下:
第一步:移取10.00 mL溶液A于100 mL容量瓶中,加水定容至100 mL。
第二步:取稀释后溶液20.00 mL于锥形瓶中,加入过量KI固体,充分反应生成白色沉淀与碘单质。
第三步:以淀粉溶液为指示剂,用0.050 00 mol·L-1的Na2S2O3标准溶液滴定,前后共测定三次,达到滴定终点时,消耗Na2S2O3标准溶液的体积如下表:(已知:I2+2S2O![]() ===2I-+S4O
===2I-+S4O![]() )
)
滴定次数 | 第一次 | 第二次 | 第三次 |
滴定前读数(mL) | 0.10 | 0.36 | 1.10 |
滴定后读数(mL) | 20.12 | 20.34 | 22.12 |
①CuSO4溶液与KI的反应的离子方程式为______________________________。
②滴定中,Na2S2O3标准溶液应放在________(填“酸式滴定管”或“碱式滴定管”)中,滴定终点的现象是______________________________。
③溶液A中c(Cu2+)=________mol·L-1。