题目内容
【题目】25℃时,向10mL0.1mol·L-1H3AsO4水溶液滴加0.1 mol·L-1NaOH溶液,含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如下图,下列说法错误的是
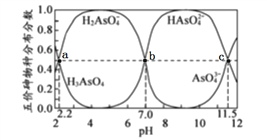
A. H3AsO4![]() H2AsO4-+H+的电离常数为10-2.2
H2AsO4-+H+的电离常数为10-2.2
B. b点所处溶液中:c(Na+)=3c(H2AsO4-)+3c(AsO43-)
C. 水的电离程度:a>b>c
D. HAsO4-的水解程度大于电离程度
【答案】C
【解析】H3AsO4![]() H2AsO4-+H+的电离常数K=c(H2AsO4-)×c(H+)/c(H3AsO4),根据图像可知,当pH=2.2时,c(H2AsO4-)=c(H3AsO4),K=10-2.2,A正确;b点所处溶液呈中性,溶液中溶质为NaH2AsO4 和Na2HAsO4混合液,根据电荷守恒:c(Na+)+ c(H+)= c(H2AsO4-)+ 3c(AsO43-)+2c(HAsO24-)+ c(OH-),从图像可知b点时:c(H+)= c(oH-), c(H2AsO4-)= c(HAsO24-),所以b点所处溶液中:c(Na+)=3c(H2AsO4-)+3c(AsO43-),B正确;酸抑制水电离,能水解的盐溶液促进水电离,因此a点时,pH=2.2时电离显酸性,b点时,pH=7,显中性,c点时,pH=11.5,水解显碱性,所以水的电离程度:a<b<c,C错误;根据图像可知,当HAsO4-的浓度分布分数为1时,溶液为NaHAsO4溶液,pH>7,显碱性,HAsO4-的水解程度大于电离程度,D正确;正确选项C。
H2AsO4-+H+的电离常数K=c(H2AsO4-)×c(H+)/c(H3AsO4),根据图像可知,当pH=2.2时,c(H2AsO4-)=c(H3AsO4),K=10-2.2,A正确;b点所处溶液呈中性,溶液中溶质为NaH2AsO4 和Na2HAsO4混合液,根据电荷守恒:c(Na+)+ c(H+)= c(H2AsO4-)+ 3c(AsO43-)+2c(HAsO24-)+ c(OH-),从图像可知b点时:c(H+)= c(oH-), c(H2AsO4-)= c(HAsO24-),所以b点所处溶液中:c(Na+)=3c(H2AsO4-)+3c(AsO43-),B正确;酸抑制水电离,能水解的盐溶液促进水电离,因此a点时,pH=2.2时电离显酸性,b点时,pH=7,显中性,c点时,pH=11.5,水解显碱性,所以水的电离程度:a<b<c,C错误;根据图像可知,当HAsO4-的浓度分布分数为1时,溶液为NaHAsO4溶液,pH>7,显碱性,HAsO4-的水解程度大于电离程度,D正确;正确选项C。

 字词句篇与同步作文达标系列答案
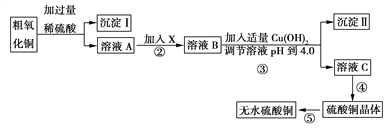
字词句篇与同步作文达标系列答案【题目】某化学活动小组按下图所示流程由粗氧化铜样品(含少量氧化亚铁及不溶于酸的杂质)制取无水硫酸铜。
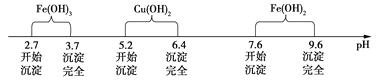
已知Fe3+、Cu2+、Fe2+三种离子在水溶液中形成氢氧化物沉淀的pH范围如下图所示:
请回答下列问题:
(1)在整个实验过程中,下列实验装置不可能用到的是________(填序号)。
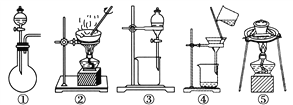
(2)溶液A中所含溶质为________;物质X应选用________(填序号)。
①氯水 ②双氧水 ③铁粉 ④高锰酸钾
(3)从溶液C中制取硫酸铜晶体的实验操作为______________________________。
(4)用“间接碘量法”可以测定溶液A(不含能与I-发生反应的杂质)中Cu2+的浓度。过程如下:
第一步:移取10.00 mL溶液A于100 mL容量瓶中,加水定容至100 mL。
第二步:取稀释后溶液20.00 mL于锥形瓶中,加入过量KI固体,充分反应生成白色沉淀与碘单质。
第三步:以淀粉溶液为指示剂,用0.050 00 mol·L-1的Na2S2O3标准溶液滴定,前后共测定三次,达到滴定终点时,消耗Na2S2O3标准溶液的体积如下表:(已知:I2+2S2O![]() ===2I-+S4O
===2I-+S4O![]() )
)
滴定次数 | 第一次 | 第二次 | 第三次 |
滴定前读数(mL) | 0.10 | 0.36 | 1.10 |
滴定后读数(mL) | 20.12 | 20.34 | 22.12 |
①CuSO4溶液与KI的反应的离子方程式为______________________________。
②滴定中,Na2S2O3标准溶液应放在________(填“酸式滴定管”或“碱式滴定管”)中,滴定终点的现象是______________________________。
③溶液A中c(Cu2+)=________mol·L-1。
【题目】对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·L-1)随时间(min)变化的有关实验数据见下表。
时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
Ⅰ(pH=2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
Ⅱ(pH=4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
Ⅳ(pH=4,含Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
下列说法不正确的是
A. 在0~20min内,I中M的分解速率为0.015 mol·L-1·min-1
p>B. 水样酸性越强,M的分解速率越快C. 在0~25min内,III中M的分解百分率比II大
D. 由于Cu2+存在,IV中M的分解速率比I快
【题目】砷化镓是继硅之后研究最深入、应用最广泛的半导体材料。回答下列问题:
(1)Ga 基态原子核外电子排布式为 ____,As 基态原子核外有_________个未成对电子。
(2)Ga、As、Se 的第一电离能中大到小的顺序是 __________,Ga、As、Se 的电负性由大到小的顺序是 ____。
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:_____。
镓的卤化物 | GaCl3 | GaBr3 | GaI3 |
熔点/℃ | 77.75 | 122.3 | 211.5 |
沸点/℃ | 201.2 | 279 | 346 |
GaF3 的熔点超过 1000 ℃,可能的原因是 _____________。
(4)二水合草酸镓的结构如图 1 所示,其中镓原子的配位数为_____,草酸根中碳原子的杂化轨道类型为 ____。

(5)砷化镓的立方晶胞结构如图 2 所示,晶胞参数为 a=0.565nm,砷化镓晶体的密度为_____g/ cm3(设 NA为阿伏加德罗常数的值,列出计算式即可)。