题目内容
6.设NA为阿伏加德罗常数,下列说法正确的是( )| A. | 将含1mol FeCl3的饱和氯化铁溶液逐滴加入沸水制备得到红褐色氢氧化铁胶体,其中含NA个Fe(OH)3胶粒 | |
| B. | 将80g NaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为2 mol/L | |
| C. | 154g CCl4 在标准状况下的体积是22.4L | |
| D. | 在标准状况时,20ml NH3与60ml O2所含分子个数比为1:3 |
分析 A.氢氧化铁胶体微粒是氢氧化铁的粒子集合体;
B.溶液体积不是1L;
C.气体摩尔体积适用对象为气体;
D.同条件下,气体体积之比等于其分子数目之比.
解答 解:A.氢氧化铁胶体微粒是氢氧化铁的粒子集合体,将含1mol FeCl3的饱和氯化铁溶液逐滴加入沸水制备得到红褐色氢氧化铁胶体,其中含Fe(OH)3胶体粒子小于NA个,故A错误;
B.将80g NaOH溶于1L水中,溶液的体积大于1L,所得溶液中NaOH的物质的量浓度小于2 mol/L,故B错误;
C.标况下四氯化碳为液体,不能使用气体摩尔体积,故C错误;
D.同温同压下,气体体积之比等于其分子数目之比,故标准状况时,20mLNH3与60mL O2所含的分子个数比=20mL:30mL=1:3,故D正确;
故选:D.
点评 本题考查了摩尔质量、气体摩尔体积、阿伏伽德罗定律、溶液浓度和体积换算物质的量,题目难度不大,注意气体摩尔体积适用对象.

练习册系列答案
相关题目
16.25℃时,pH均为11的Na2CO3溶液和NaOH溶液,则由水电离的OH-离子浓度之比为( )
| A. | 1010:1 | B. | 5×109:1 | C. | 108:1 | D. | 1:1 |
1.下列分散系最稳定的是( )
| A. | 悬浊液 | B. | 乳浊液 | C. | 胶体 | D. | 溶液 |
11.YBa2Cu8O2(Y为元素钇)是磁悬浮列车中的重要超导材料,下列关于${\;}_{39}^{59}Y$的说法不正确的是( )
| A. | 属于金属元素 | |
| B. | 质子数与中子数之差为50 | |
| C. | 原子的核外电子数是39 | |
| D. | ${\;}_{39}^{49}$Y和${\;}_{39}^{50}$Y是两种不同的核素 |
1.某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
实验原理2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
实验内容及记录
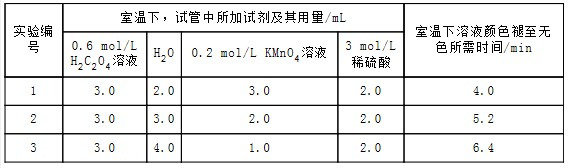
请回答:
(1)根据上表中的实验数据,可以得到的结论是其他条件相同时,增大KMnO4浓度反应速率增大.
(2)利用实验1中数据计算,若用KMnO4的浓度变化表示的反应速率为:υ(KMnO4)=1.5×10-2mol/(L•min).
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示.但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示.该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究.
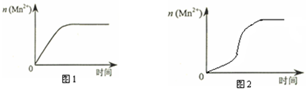
①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用).
②请你帮助该小组同学完成实验方案,并填写表中空白.
③若该小组同学提出的假设成立,应观察到的现象是与实验1比较,溶液褪色所需时间短.
(4)工业上可用电解K2MnO4浓溶液的方法制取KMnO4,则电解时,阳极发生的电极反应为MnO42--e-=MnO4-;总方程式为2K2MnO4+2H2O═2KMnO4+2KOH+H2↑.
实验原理2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
实验内容及记录

请回答:
(1)根据上表中的实验数据,可以得到的结论是其他条件相同时,增大KMnO4浓度反应速率增大.
(2)利用实验1中数据计算,若用KMnO4的浓度变化表示的反应速率为:υ(KMnO4)=1.5×10-2mol/(L•min).
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示.但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示.该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究.
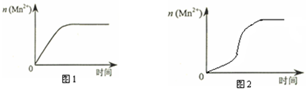
①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用).
②请你帮助该小组同学完成实验方案,并填写表中空白.
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 3 mol/L 稀硫酸 | 0.05 mol/L KMnO4溶液 | |||
| 4 | 3.0 | 2.0 | 2.0 | 3.0 | t | |
(4)工业上可用电解K2MnO4浓溶液的方法制取KMnO4,则电解时,阳极发生的电极反应为MnO42--e-=MnO4-;总方程式为2K2MnO4+2H2O═2KMnO4+2KOH+H2↑.
18.下列说法中正确的一组是( )
| A. | H2和D2互为同位素 | B. | 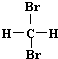 和 和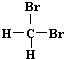 互为同分异构体 互为同分异构体 | ||
| C. | H、D、T互称为同素异形体 | D. | 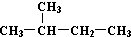 和 和 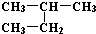 是同一种物质 是同一种物质 |
19.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,22.4L甲醇中含有的氧原子数为1.0NA | |
| B. | 常温常压下,46gNO2与 N2O4的混合气体中含有的原子总数为3NA | |
| C. | 标准状况下,2.24LCl2与足量的稀NaOH溶液反应,转移电子总数为0.2NA | |
| D. | 1L 1 mol•L-1的盐酸中,所含氯化氢分子数为NA |