题目内容
将6g纯铁粉加入200mLFe2(SO4)3和CuSO4的混合溶液中充分反应后得到200mL0.5mol/L的FeSO4溶液和5.2g固体,求:
 (1)反应后生成铜多少克?
(1)反应后生成铜多少克?
 (2)加入铁粉前Fe2(SO4)3物质的量浓度。
(2)加入铁粉前Fe2(SO4)3物质的量浓度。
 (1)反应后生成铜多少克?
(1)反应后生成铜多少克? (2)加入铁粉前Fe2(SO4)3物质的量浓度。
(2)加入铁粉前Fe2(SO4)3物质的量浓度。(1)2.56g(2)0.1mol/L
 发生反应的化学方程式为:
发生反应的化学方程式为: ①Fe+Fe2(SO4)3=3FeSO4 ②Fe+CuSO4=Cu+FeSO4
①Fe+Fe2(SO4)3=3FeSO4 ②Fe+CuSO4=Cu+FeSO4 两个反应共生成FeSO4为:0.2L×0.5mol/L=0.1mol
两个反应共生成FeSO4为:0.2L×0.5mol/L=0.1mol 观察两个反应不难发现,若生成同样的FeSO4,②式消耗的铁更多。假设0.1molFeSO4全部为②式产生,则此时消耗的铁将达最大量为a。
观察两个反应不难发现,若生成同样的FeSO4,②式消耗的铁更多。假设0.1molFeSO4全部为②式产生,则此时消耗的铁将达最大量为a。




 Fe ~ FeSO4
Fe ~ FeSO4 1mol 1mol
1mol 1mol a 0.1mol
a 0.1mol a=0.1mol,即铁为5.6g,则5.2g固体中含Cu也含剩余的Fe,设原溶液的Fe2(SO4)3和CuSO4的物质的量分别为x和y。
a=0.1mol,即铁为5.6g,则5.2g固体中含Cu也含剩余的Fe,设原溶液的Fe2(SO4)3和CuSO4的物质的量分别为x和y。 Fe+Fe2(SO4)3=3FeSO4 Fe+CuSO4=Cu+FeSO4
Fe+Fe2(SO4)3=3FeSO4 Fe+CuSO4=Cu+FeSO4 X x 3x y y y y
X x 3x y y y y
 由题意得 3x+y=0.1mol
由题意得 3x+y=0.1mol 6g-56g/mol×(x+y)+64g/mol×y=5.2g
6g-56g/mol×(x+y)+64g/mol×y=5.2g 解得:x="0.02mol " y=0.04mol
解得:x="0.02mol " y=0.04mol 则生成铜:0.04mol×64g/mol=2.56g
则生成铜:0.04mol×64g/mol=2.56g 原Fe2(SO4)3和物质的量浓度为0.02mol/0.2L=0.1mol/L
原Fe2(SO4)3和物质的量浓度为0.02mol/0.2L=0.1mol/L
练习册系列答案
相关题目
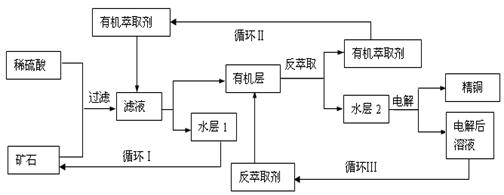
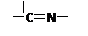 (3)“循环Ⅱ”中萃取剂是一类称作为肟类的有机化合物,如N-510、N-530等。某肟类化合物A的分
(3)“循环Ⅱ”中萃取剂是一类称作为肟类的有机化合物,如N-510、N-530等。某肟类化合物A的分