题目内容
mg 铁粉与一定量的HNO3在一定条件下充分反应,将生成的气体与标准状况nL氧气混合,恰好能被水完全吸收,m和n的关系是什么?
O.2m≤n≤O.3m
 此题看起来,涉及的化学反应相当复杂,因HNO3的浓度和用量不同,生成Fe(NO3)3还是Fe(NO3)2不能确定,HNO3的还原产物是NO还是NO2也不能确定。所以消耗的氧气也无从下手求出.但是从始态和终态来看,HNO3的还原产物与氧气混合后,最终还是生成HNO3,这样消耗的氧气相当于把mg铁粉氧化成+2价或+3价化合物,用极端思考法很容易求出。
此题看起来,涉及的化学反应相当复杂,因HNO3的浓度和用量不同,生成Fe(NO3)3还是Fe(NO3)2不能确定,HNO3的还原产物是NO还是NO2也不能确定。所以消耗的氧气也无从下手求出.但是从始态和终态来看,HNO3的还原产物与氧气混合后,最终还是生成HNO3,这样消耗的氧气相当于把mg铁粉氧化成+2价或+3价化合物,用极端思考法很容易求出。
 假设HNO3为稀的,铁与HNO3反应后的价态是+2,
假设HNO3为稀的,铁与HNO3反应后的价态是+2, 则有: 3 Fe +8 HNO3=" 3" Fe(NO3)2 + 2 NO↑+ 4 H2O (1)
则有: 3 Fe +8 HNO3=" 3" Fe(NO3)2 + 2 NO↑+ 4 H2O (1) 4NO +3O2 +2H2O=4HNO3 (2)
4NO +3O2 +2H2O=4HNO3 (2) (1)×2 +(2)得:2Fe + O2 +4HNO3= 2Fe(NO3)2 +2H2O
(1)×2 +(2)得:2Fe + O2 +4HNO3= 2Fe(NO3)2 +2H2O 可改写为 : 2Fe + O2 +4HNO3 =" " 2FeO + 4HNO3
可改写为 : 2Fe + O2 +4HNO3 =" " 2FeO + 4HNO3 即: 2Fe + O2 =2FeO
即: 2Fe + O2 =2FeO 同理可得 : 4Fe +3O2=2Fe2O3 问题便得以解决
同理可得 : 4Fe +3O2=2Fe2O3 问题便得以解决 即 :当铁被氧化为+2价时,由电子得失守衡得:
即 :当铁被氧化为+2价时,由电子得失守衡得: m/56×2=n/22.4×4 n=O.2m
m/56×2=n/22.4×4 n=O.2m 当铁被氧化为=+3价时,由电子得失守衡得:
当铁被氧化为=+3价时,由电子得失守衡得: m/56×3=n/22.4×4 n="O.3m "
m/56×3=n/22.4×4 n="O.3m "  则m与n的关系是:O.2m≤n≤O.3m
则m与n的关系是:O.2m≤n≤O.3m
练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
 (1)反应后生成铜多少克?
(1)反应后生成铜多少克?
 ,
,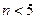 ,m<10}分批加入,利用PFS在水体中形成絮状物,以吸附镉离子。结合题中信息,下列说法不正确的是
,m<10}分批加入,利用PFS在水体中形成絮状物,以吸附镉离子。结合题中信息,下列说法不正确的是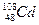 核素中中子数为60
核素中中子数为60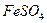 溶液制PFS需经过氧化、水解和聚合的过程
溶液制PFS需经过氧化、水解和聚合的过程