题目内容
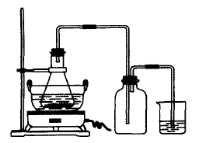
(1)Fe3O4 Fe (2)3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g) 置换反应(或氧化还原反应)。
Fe3O4(s)+4H2(g) 置换反应(或氧化还原反应)。
 Fe3O4(s)+4H2(g) 置换反应(或氧化还原反应)。
Fe3O4(s)+4H2(g) 置换反应(或氧化还原反应)。由于A为黑色粉末,且有磁性,所以可推测A为Fe3O4;由于B为黑色粉末,能被磁铁吸引,所以可推测B为Fe。这样,①②③反应分别是:
①3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g)
Fe3O4(s)+4H2(g)
②3Fe+2O2 Fe3O4
Fe3O4
③Fe3O4+4H2 3Fe+4H2O
3Fe+4H2O
反应①是置换反应,也是氧化还原反应。
①3Fe(s)+4H2O(g)
 Fe3O4(s)+4H2(g)
Fe3O4(s)+4H2(g)②3Fe+2O2
 Fe3O4
Fe3O4③Fe3O4+4H2
 3Fe+4H2O
3Fe+4H2O反应①是置换反应,也是氧化还原反应。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 (1)反应后生成铜多少克?
(1)反应后生成铜多少克?