题目内容
现代社会中铜在电气、交通、机械和冶金、能源及石化工业、高科技等领域有广泛的应用。
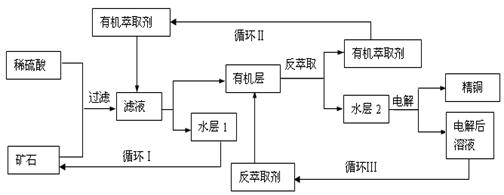
某铜矿石含氧化铜、氧化亚铜、三氧化二铁和脉石(SiO2),现采用酸浸法从矿石中提取铜,其工艺流程图如下。其中铜的萃取(铜从水层进入有机层的过程)和反萃取(铜从有机层进入水层的过程)是现代湿法炼铜的重要工艺手段。
已知:①Cu2O+2H+=Cu2++Cu+H2O;②当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混
合液浸出铜;③反萃取后的水层2是硫酸铜溶液。
回答下列问题:
(1) 矿石用稀硫酸处理过程中发生反应的离子方程式为:Cu2O+2H+=Cu2++Cu+H2O、
、 (任写其中2个)。
(2)“循环Ⅰ”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的硫酸盐晶体,该晶体
的化学式是 。若水层1暴露在空气中一段时间后,可以得到另一种重要的硫酸盐,写
出水层1暴露在空气中发生反应的离子方程式 。
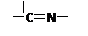 (3)“循环Ⅱ”中萃取剂是一类称作为肟类的有机化合物,如N-510、N-530等。某肟类化合物A的分
(3)“循环Ⅱ”中萃取剂是一类称作为肟类的有机化合物,如N-510、N-530等。某肟类化合物A的分
子结构中仅含n1个 —CH3、n2个 —OH 和n3个 三种基团,无环状结构,三种基团的数
目关系为n3= 。若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,
则A的结构简式是 。
(4) 写出电解过程中阳极(惰性电极)发生反应的电极反应式: 。
(5)“循环Ⅲ”中反萃取剂的主要成分是 。
某铜矿石含氧化铜、氧化亚铜、三氧化二铁和脉石(SiO2),现采用酸浸法从矿石中提取铜,其工艺流程图如下。其中铜的萃取(铜从水层进入有机层的过程)和反萃取(铜从有机层进入水层的过程)是现代湿法炼铜的重要工艺手段。
 |
已知:①Cu2O+2H+=Cu2++Cu+H2O;②当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混
合液浸出铜;③反萃取后的水层2是硫酸铜溶液。
回答下列问题:
(1) 矿石用稀硫酸处理过程中发生反应的离子方程式为:Cu2O+2H+=Cu2++Cu+H2O、
、 (任写其中2个)。
(2)“循环Ⅰ”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的硫酸盐晶体,该晶体
的化学式是 。若水层1暴露在空气中一段时间后,可以得到另一种重要的硫酸盐,写
出水层1暴露在空气中发生反应的离子方程式 。
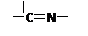 (3)“循环Ⅱ”中萃取剂是一类称作为肟类的有机化合物,如N-510、N-530等。某肟类化合物A的分
(3)“循环Ⅱ”中萃取剂是一类称作为肟类的有机化合物,如N-510、N-530等。某肟类化合物A的分子结构中仅含n1个 —CH3、n2个 —OH 和n3个 三种基团,无环状结构,三种基团的数
目关系为n3= 。若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,
则A的结构简式是 。
(4) 写出电解过程中阳极(惰性电极)发生反应的电极反应式: 。
(5)“循环Ⅲ”中反萃取剂的主要成分是 。
(1) CuO+2H+==Cu2++H2O、Fe2O3+6H+==2Fe3++3H2O、Cu+2Fe3+==2Fe2++ Cu2+
(2) FeSO4?7H2O ,4Fe2++O2+4H+==4Fe3+ +2H2O
(3) n3= (n1+n2-2) CH3—C(=N-OH)—C(=N-OH)—CH3
(4) 4OH--4e-="=" O2+2H2O (5) H2SO4
(2) FeSO4?7H2O ,4Fe2++O2+4H+==4Fe3+ +2H2O
(3) n3= (n1+n2-2) CH3—C(=N-OH)—C(=N-OH)—CH3
(4) 4OH--4e-="=" O2+2H2O (5) H2SO4
本题看似考察酸浸法从矿石中提取铜这样一个复杂的工艺流程,实际上考察了常见金属及其化合物的性质(1、2两问)、电解精炼铜(4、5两问)及对有机物结构的体认(3) 。
(1)由矿石成分知氧化铜、氧化铁与硫酸反应。
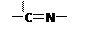
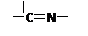 (2)因有铜单质析出,故不能存在亚铁离子,且亚铁离子的强还原性易被氧化为铁离子。
(2)因有铜单质析出,故不能存在亚铁离子,且亚铁离子的强还原性易被氧化为铁离子。
(3)—CH3、 —OH是端头基。 是分子的骨架,一个 就需多一个端头基,加上链首尾的两个端头基,共需端头基n3+2,即n3+2=n1+n2。
(4) 电解精炼铜,阳极放电离子是OH-。
(5)由电解精炼铜知生成硫酸,反萃取剂是硫酸。
(1)由矿石成分知氧化铜、氧化铁与硫酸反应。
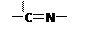
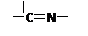 (2)因有铜单质析出,故不能存在亚铁离子,且亚铁离子的强还原性易被氧化为铁离子。
(2)因有铜单质析出,故不能存在亚铁离子,且亚铁离子的强还原性易被氧化为铁离子。(3)—CH3、 —OH是端头基。 是分子的骨架,一个 就需多一个端头基,加上链首尾的两个端头基,共需端头基n3+2,即n3+2=n1+n2。
(4) 电解精炼铜,阳极放电离子是OH-。
(5)由电解精炼铜知生成硫酸,反萃取剂是硫酸。

练习册系列答案
相关题目
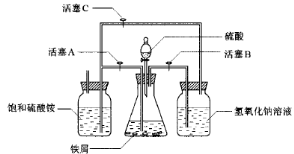
 (1)反应后生成铜多少克?
(1)反应后生成铜多少克? ,
,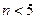 ,m<10}分批加入,利用PFS在水体中形成絮状物,以吸附镉离子。结合题中信息,下列说法不正确的是
,m<10}分批加入,利用PFS在水体中形成絮状物,以吸附镉离子。结合题中信息,下列说法不正确的是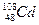 核素中中子数为60
核素中中子数为60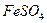 溶液制PFS需经过氧化、水解和聚合的过程
溶液制PFS需经过氧化、水解和聚合的过程