题目内容
(1)写出工业用纯碱、石灰石、石英制普通玻璃的化学方程式______.
(2)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液.原因是______(用化学方程式表式).
(3)向100mL水中投入Na和Al共16克,充分反应后分析剩余金属1g.计算放出H2的体积为______升(标准状况下)
(4)向含有0.3mol的NaAlO2溶液中滴加1mol/LHCl,当生成7.8克沉淀时,加入盐酸的体积为______mL.
(5)向一定量的Fe、Fe2O3和CuO混合物投入120mL2.2mol/L的硫酸溶液中,充分反应后生成896mL标准状况下的气体,得不溶物1.28g,过滤后,向滤液中加入2mol/L的NaOH溶液,加至40mL时开始出现沉淀,则滤液中FeSO4的物质的量浓度为______(设滤液体积为120mL)mol/L.
(2)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液.原因是______(用化学方程式表式).
(3)向100mL水中投入Na和Al共16克,充分反应后分析剩余金属1g.计算放出H2的体积为______升(标准状况下)
(4)向含有0.3mol的NaAlO2溶液中滴加1mol/LHCl,当生成7.8克沉淀时,加入盐酸的体积为______mL.
(5)向一定量的Fe、Fe2O3和CuO混合物投入120mL2.2mol/L的硫酸溶液中,充分反应后生成896mL标准状况下的气体,得不溶物1.28g,过滤后,向滤液中加入2mol/L的NaOH溶液,加至40mL时开始出现沉淀,则滤液中FeSO4的物质的量浓度为______(设滤液体积为120mL)mol/L.
(1)高温下,碳酸钠、碳酸钙分别和二氧化硅反应生成硅酸盐和二氧化碳,反应方程式分别为:Na2CO3+SiO2
Na2SiO3+CO2↑、CaCO3+SiO2
CaSiO3+CO2↑,故答案为:Na2CO3+SiO2
Na2SiO3+CO2↑、CaCO3+SiO2
CaSiO3+CO2↑;
(2)氢氧化亚铁不稳定,易被氧化生成氢氧化铁,反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)Al和水不反应,所以剩余金属应该是Al,反应方程式为2Na+2H2O=2NaOH+H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,可以得出关系式Na~NaOH~Al,则参与反应的Na和Al的质量之比为23:27,Na和Al的质量和为15g,所以n(Na)=
=0.3mol,n(Al)=
=0.3mol,根据Na、Al和氢气之间的关系式得氢气体积=(0.3mol×0.5+0.3mol×1.5)×22.4L/mol=13.44L,
故答案为:13.44;
(4)n(Al(OH)3)=
=0.1mol<0.3mol,一种情况是:铝元素存在于偏铝酸钠和氢氧化铝中,
此时盐酸少量,只能沉淀一部分AlO2-,根据NaAlO2+HCl+H2O=Al(OH)3↓+NaCl得,n(HCl)=n(Al(OH)3)=0.1mol,则盐酸体积=
=100mL;
另一种情况是铝元素存在于氯化铝和氢氧化铝中,此时盐酸较多,先把AlO2-全部沉淀,后又将部分沉淀溶解,生成氢氧化铝需要n(HCl)=n(NaAlO2)=n(Al(OH)3)=0.3mol,溶解Al(OH)3生成氯化铝需要盐酸的n(HCl)=3n(AlCl3)=3×(0.3-0.1)mol=0.6mol,所以需要盐酸体积=
=900mL,
故答案为:100或900;
(5)固体混合物和稀硫酸反应后有固体剩余,说明溶液中不存在铁离子,向滤液中加入加入2mol/L的NaOH溶液,加至40mL时开始出现沉淀,说明硫酸有剩余,铁先和铜离子后和氢离子发生置换反应,所以滤液中的溶质是硫酸、硫酸亚铁,n(H2SO4)=2.2mol/L×0.12L=0.264mol,
与氢氧化钠反应的硫酸的物质的量=
n(NaOH)=
×2mol/L×0.04L=0.04mol,
剩余的硫酸的物质的量=0.264mol-0.04mol=0.224mol,
剩余硫酸与固体反应生成了硫酸亚铁,根据硫酸和硫酸亚铁的关系式计算硫酸亚铁的物质的量浓度=
=1.87mol/L,
故答案为:1.87.
| ||
| ||
| ||
| ||
(2)氢氧化亚铁不稳定,易被氧化生成氢氧化铁,反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)Al和水不反应,所以剩余金属应该是Al,反应方程式为2Na+2H2O=2NaOH+H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,可以得出关系式Na~NaOH~Al,则参与反应的Na和Al的质量之比为23:27,Na和Al的质量和为15g,所以n(Na)=
| ||
| 23g/mol |
| ||
| 27g/mol |
故答案为:13.44;
(4)n(Al(OH)3)=
| 7.8g |
| 78g/mol |
此时盐酸少量,只能沉淀一部分AlO2-,根据NaAlO2+HCl+H2O=Al(OH)3↓+NaCl得,n(HCl)=n(Al(OH)3)=0.1mol,则盐酸体积=
| 0.1mol |
| 1mol/L |
另一种情况是铝元素存在于氯化铝和氢氧化铝中,此时盐酸较多,先把AlO2-全部沉淀,后又将部分沉淀溶解,生成氢氧化铝需要n(HCl)=n(NaAlO2)=n(Al(OH)3)=0.3mol,溶解Al(OH)3生成氯化铝需要盐酸的n(HCl)=3n(AlCl3)=3×(0.3-0.1)mol=0.6mol,所以需要盐酸体积=
| 0.3mol+0.6mol |
| 1mol/L |
故答案为:100或900;
(5)固体混合物和稀硫酸反应后有固体剩余,说明溶液中不存在铁离子,向滤液中加入加入2mol/L的NaOH溶液,加至40mL时开始出现沉淀,说明硫酸有剩余,铁先和铜离子后和氢离子发生置换反应,所以滤液中的溶质是硫酸、硫酸亚铁,n(H2SO4)=2.2mol/L×0.12L=0.264mol,
与氢氧化钠反应的硫酸的物质的量=
| 1 |
| 2 |
| 1 |
| 2 |
剩余的硫酸的物质的量=0.264mol-0.04mol=0.224mol,
剩余硫酸与固体反应生成了硫酸亚铁,根据硫酸和硫酸亚铁的关系式计算硫酸亚铁的物质的量浓度=
| 0.224mol |
| 0.12L |
故答案为:1.87.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (1)反应后生成铜多少克?
(1)反应后生成铜多少克?

 ,
,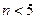 ,m<10}分批加入,利用PFS在水体中形成絮状物,以吸附镉离子。结合题中信息,下列说法不正确的是
,m<10}分批加入,利用PFS在水体中形成絮状物,以吸附镉离子。结合题中信息,下列说法不正确的是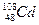 核素中中子数为60
核素中中子数为60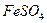 溶液制PFS需经过氧化、水解和聚合的过程
溶液制PFS需经过氧化、水解和聚合的过程