题目内容
【题目】(1)t1℃时,密闭容器中,通入一定量的CO和H2O,发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0。容器中各物质浓度(单位:mol·L-1)变化如下表所示:
CO2(g)+H2(g) ΔH<0。容器中各物质浓度(单位:mol·L-1)变化如下表所示:
时间(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
①一定处于平衡状态的时间段为___。
②5~6min时间段内,平衡移动方向为___(填“向左移动”或“向右移动”),根据表中数据判断,平衡移动的原因是___(填字母编号)。
a.增加了H2O(g)的量 b.增加氢气浓度
c.使用催化剂 d.降低温度
③t2℃时(t2>t1),在相同条件下发生上述反应,达平衡时,CO浓度___c1(填“>”“<”或“=”)。
(2)已知反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数随温度变化情况如图1所示:
FeO(s)+CO(g)的平衡常数随温度变化情况如图1所示:

①用CO还原FeO制备Fe的反应是___(填“吸热”或“放热”)反应。
②温度为T2时,实验测得该反应体系中CO浓度为CO2的2.5倍,则T2___T1(填“>”“<”或“=”)。
(3)工业上常用CO、CO2和H2合成甲醇燃料,其原理为:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH<0
CH3OH(g) ΔH<0
②CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH>0
CO(g)+H2O(g) ΔH>0
当混合气体的组成固定时,CO平衡转化率(α)与温度和压强的关系如图2所示。
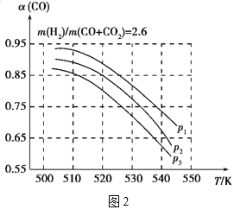
图中的压强由大到小的顺序为___,判断理由是___;试解释CO平衡转化率随温度升高而减小的原因是___。
【答案】3~4 min 向右移动 a > 放热 > p1>p2>p3 相同温度下,由于反应①为气体分子数减小的反应,加压平衡正向移动,CO转化率增大,而反应②为气体分子数不变的反应,产生CO的量不受压强影响,故增大压强时,有利于提高CO的转化率 反应①为放热反应,升高温度,平衡逆向移动,使得体系中CO的量增大,反应②为吸热反应,升高温度时,平衡正向移动,产生CO的量增大,总结果就是随温度升高,CO的转化率减小
【解析】
⑴①从表格中数据分析,体系中各物质的浓度不再变化的时间就为达到平衡状态;根据数据看出H2O(g)的浓度增大,CO的浓度减小,说明是增加了H2O(g)的量;反应的正反应为放热反应,升高温度,平衡逆向移动,CO转化率减小。
⑵升高温度,化学平衡常数增大,正反应为吸热反应,则其逆反应为放热反应,计算T2的K值,与T1的K值比较,得出温度关系。
⑶由于反应①为气体分子数减小的反应,加压平衡正向移动,CO转化率增大,而反应②为气体分子数不变的反应,产生CO的量不受压强影响,故增大压强时,有利于提高CO的转化;反应①为放热反应,升高温度,平衡逆向移动,使得体系中CO的量增大,反应②为吸热反应,升高温度时,平衡正向移动,产生CO的量增大,总结果就是随温度升高,CO的转化率减小。
⑴①从表格中数据分析,第3~4 min时,体系中各物质的浓度不再变化,说明反应已经达到平衡状态,故答案为:3~4 min。
②5~6min时间段内,H2O(g)的浓度增大,CO的浓度减小,说明是增加了H2O(g)的量,使平衡正向移动,故答案为:向右移动;a。
③该反应的正反应为放热反应,升高温度,平衡逆向移动,CO转化率减小,则t2℃反应达到平衡时,CO浓度 > c1,故答案为:>。
⑵①由题图1可知,升高温度,化学平衡常数增大,说明Fe(s)+CO2(g)![]() FeO(s)+CO(g)为吸热反应,则其逆反应为放热反应,故答案为:放热。
FeO(s)+CO(g)为吸热反应,则其逆反应为放热反应,故答案为:放热。
②K(T2)=c(CO)/c(CO2)=2.5 > K(T1),根据图像信息可知,K越大,对应的温度越高,所以T2>T1,故答案为:>。
⑶反应①是体积减小的反应,反应②是等体积反应,从上到下,转化率增长,说明是增大压强,因此压强由大到小的顺序为p1>p2>p3,判断理由是相同温度下,由于反应①为气体分子数减小的反应,加压平衡正向移动,CO转化率增大,而反应②为气体分子数不变的反应,产生CO的量不受压强影响,故增大压强时,有利于提高CO的转化率,CO平衡转化率随温度升高而减小的原因应①为放热反应,升高温度,平衡逆向移动,使得体系中CO的量增大,反应②为吸热反应,升高温度时,平衡正向移动,产生CO的量增大,总结果就是随温度升高,CO的转化率减小,故答案为:p1>p2>p3;相同温度下,由于反应①为气体分子数减小的反应,加压平衡正向移动,CO转化率增大,而反应②为气体分子数不变的反应,产生CO的量不受压强影响,故增大压强时,有利于提高CO的转化率;反应①为放热反应,升高温度,平衡逆向移动,使得体系中CO的量增大,反应②为吸热反应,升高温度时,平衡正向移动,产生CO的量增大,总结果就是随温度升高,CO的转化率减小。

 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案