题目内容
【题目】化学与生产、生活、科技密切相关,下列有关说法正确的是( )
A.硅胶的主要成分是![]()
B.华为最新一代旗舰芯片麒麟9905G中半导体材料为二氧化硅
C.燃放烟花呈现出多种颜色是由于烟花中添加了![]() 、
、![]() 、
、![]() 、
、![]() 等金属的单质
等金属的单质
D.“钻酞菁”(分子直径为![]() )在水中形成的分散系能产生丁达尔效应
)在水中形成的分散系能产生丁达尔效应
【答案】D
【解析】
A. 硅胶是一种高活性吸附材料,属非晶态物质,其化学分子式为mSiO2·nH2O,故A错误;
B. 作为半导体材料的应该是硅单质,故B错误;
C. 燃放烟花呈现出多种颜色是由于烟花中添加了Na、Cu等金属元素,不是单质,故C错误;
D. “钴酞菁”分子直径为1.3×109米,介于胶体的分散质粒子直径的范围内,“钻酞菁”在水中形成的分散系属于胶体,具有丁达尔效应,故D正确。
故选D。

 智慧小复习系列答案
智慧小复习系列答案【题目】(1)t1℃时,密闭容器中,通入一定量的CO和H2O,发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0。容器中各物质浓度(单位:mol·L-1)变化如下表所示:
CO2(g)+H2(g) ΔH<0。容器中各物质浓度(单位:mol·L-1)变化如下表所示:
时间(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
①一定处于平衡状态的时间段为___。
②5~6min时间段内,平衡移动方向为___(填“向左移动”或“向右移动”),根据表中数据判断,平衡移动的原因是___(填字母编号)。
a.增加了H2O(g)的量 b.增加氢气浓度
c.使用催化剂 d.降低温度
③t2℃时(t2>t1),在相同条件下发生上述反应,达平衡时,CO浓度___c1(填“>”“<”或“=”)。
(2)已知反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数随温度变化情况如图1所示:
FeO(s)+CO(g)的平衡常数随温度变化情况如图1所示:
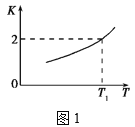
①用CO还原FeO制备Fe的反应是___(填“吸热”或“放热”)反应。
②温度为T2时,实验测得该反应体系中CO浓度为CO2的2.5倍,则T2___T1(填“>”“<”或“=”)。
(3)工业上常用CO、CO2和H2合成甲醇燃料,其原理为:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH<0
CH3OH(g) ΔH<0
②CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH>0
CO(g)+H2O(g) ΔH>0
当混合气体的组成固定时,CO平衡转化率(α)与温度和压强的关系如图2所示。

图中的压强由大到小的顺序为___,判断理由是___;试解释CO平衡转化率随温度升高而减小的原因是___。
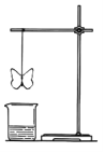
【题目】某同学用滤纸折成一个纸蝴蝶,并喷洒一种溶液(保持湿润),挂在铁架台上,将盛某种溶液的烧杯放在纸蝴蝶的下方,如图所示。向烧杯中加入另一种物质,过一会儿发现纸蝴蝶变为红色且保持红色不变,下面的组合能够实现上述变化的是( )
A | B | C | D | |
纸蝴蝶上的喷洒液 | 石蕊 | 酚酞 | 酚酞 | 石蕊 |
烧杯中的溶液 | 浓硫酸 | 氯化铵 | 稀硫酸 | 高锰酸钾 |
加入烧杯中的物质 | 铜 | 氢氧化钠浓溶液 | 氨水 | 浓盐酸 |
A.AB.BC.CD.D
【题目】一定温度下,将4molA(g)和2molB(g)充入2L恒容密闭容器中,发生2A(g)+B(g) ![]() 2C(g),一段时间达到平衡,反应过程中测定的数据如下表。下列说法正确的是
2C(g),一段时间达到平衡,反应过程中测定的数据如下表。下列说法正确的是
t/min | 2 | 4 | 8 | 9 |
n(B)/mol | 1.5 | 1.2 | 1.0 | 1.0 |
A.该温度下反应的平衡常数K=1.0
B.反应0~4 min的平均速率υ(C)=0.4 molL﹣1min﹣1
C.其他条件不变,升高温度反应的平衡常数增大,则该反应为吸热反应
D.其他条件不变,再充入4molA(g),达到新平衡时A的浓度减小,B的转化率增大