题目内容
6. 如图,利用培养皿探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面.下列对实验现象所做的解释正确的是( )
如图,利用培养皿探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面.下列对实验现象所做的解释正确的是( )| A. | 浓盐酸附近产生白烟:NH3与HCl气体反应产生了NH4Cl固体 | |
| B. | 浓硫酸附近无明显现象:NH3与浓硫酸不发生反应 | |
| C. | 氯化物溶液变浑浊:该溶液一定是AlCl3溶液 | |
| D. | 湿润的红色石蕊试纸变蓝:NH3的水溶液显碱性 |
分析 NaOH溶于水放出热量,升高温度促进氨水挥发,
A.氨气和HCl反应生成白色固体;
B.浓硫酸没有挥发性,浓硫酸和氨气反应生成铵盐;
C.能和氨气反应生成沉淀的氯化物不一定是氯化铝;
D.氨气和水反应生成一水合氨,一水合氨电离出氢氧根离子而使氨水溶液呈碱性,湿润的红色石蕊试纸遇碱变蓝色.
解答 解:NaOH溶于水放出热量,升高温度促进氨水挥发,
A.浓盐酸具有挥发性,氨气和HCl反应生成白色固体氯化铵,所以看到的现象是有白烟生成,故A正确;
B.浓硫酸没有挥发性,氨气属于碱性气体,所以浓硫酸和氨气反应生成硫酸铵,故B错误;
C.能和氨气反应生成沉淀的氯化物不一定是氯化铝,如氯化亚铁、氯化铁等都能和氨气反应生成沉淀,故C错误;
D.氨气和水反应生成一水合氨,一水合氨电离出氢氧根离子而使氨水溶液呈碱性,湿润的红色石蕊试纸遇碱变蓝色,所以湿润的红色石蕊试纸变蓝:NH3的水溶液显碱性,故D正确;
故选AD.
点评 本题考查氨气、浓盐酸、浓硫酸的性质,侧重考查元素化合物知识,可以利用AD现象检验氨气的存在,题目难度不大.

练习册系列答案
相关题目
16.下列实验叙述或现象描述正确的是( )
| A. | 液溴易挥发,在存放液溴的试剂瓶中应加水封 | |
| B. | 常温下用铝制品贮运浓硫酸,常温下也可用钢瓶贮存干燥的Cl2,因为互相不发生反应 | |
| C. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用;在空气中,镀锌铁板比铁板更耐腐蚀 | |
| D. | 高温下用焦炭还原SiO2制取粗硅;二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
17.NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下,含NA个氩原子的氩气的体积约为11.2 L | |
| B. | 31g白磷分子中,含有的共价单键数目是NA个 | |
| C. | 6 g金刚石晶体中含有的碳碳键数目为2×6.02×1023 | |
| D. | 4.5 g SiO2晶体中含有的硅氧键数目为0.3×6.02×1023 |
1.如图所示的实验操作,能达到相应目的是( )
| A. | 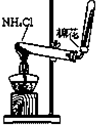 实验室制氯气 | B. |  检验K2CO3中的K+ | ||
| C. | 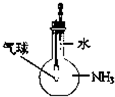 证明氨气吸易溶于水 | D. |  排水集气法收集NO |
15.把0.05mol NaOH固体分别加入到下列100mL液体中,溶液的导电能力变化不大的是( )
| A. | 自来水 | B. | 0.5 mol•L-1盐酸 | ||
| C. | 0.5 mol•L-1 醋酸 | D. | 0.5 mol•L-1 氨水 |



 .
.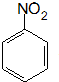 、F
、F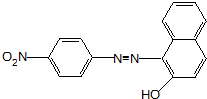 .
.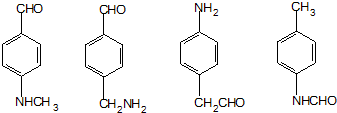 (其中两种).
(其中两种).