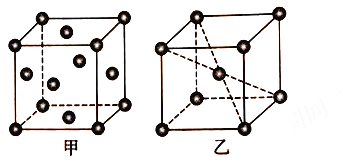
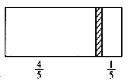
题目内容
【题目】ClO2和NaClO2均具有漂白性,工业上用ClO2气体制NaClO2的工艺流程如图所示。
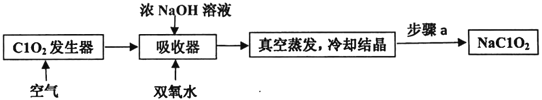
下列说法不正确的是
A. 步骤a的操作包括过滤、洗涤和干燥
B. 吸收器中生成NaClO2的离子方程式:2ClO2+H2O2=2C1O2-+O2↑+2H+
C. 工业上可将ClO2制成NaClO2固体,便于贮存和运输
D. 通入空气的目的是驱赶出ClO2,使其被吸收器充分吸收
【答案】B
【解析】A. 步骤a中,由溶液得到NaClO2固体,进行的操作为:过滤、洗涤和干燥,A正确;B. 吸收器中发生反应:2ClO2+2NaOH+H2O2═2NaClO2+O2+2H2O,离子方程式为: 2ClO2+2OH+H2O2=2ClO2-+O2+2H2O,B错误;C. 固体比气体便于贮存和运输,工业上可将ClO2制成NaClO2固体,C正确;D. 反应结束后,发生器中仍有少量ClO2,用空气可以将其排出,确保其在吸收器中被充分吸收,D正确。答案选B.

【题目】页岩气是从页岩层中开采的一种非常重要的天然气资源,页岩气的主要成分是甲烷,是公认的洁净能源。
(1)页岩气不仅能用作燃料,还可用于生产合成气(CO和H2)。CH4与H2O(g)通入聚焦太阳能反应器,发生反应CH4(g)+H2O(g) = CO(g)+3H2(g) ΔH1。已知:CH4、H2、CO的燃烧热(ΔH)分别为-a kJ·mol-1、-b kJ·mol-1、-c kJ·mol-1;H2O(l)=H2O(g) ΔH=+d kJ·mol-1。
则ΔH1=______________(用含字母a、b、c、d的代数式表示)kJ·mol-1。
(2)用合成气生成甲醇的反应为CO(g)+2H2(g)![]() CH3OH(g) ΔH2,在10 L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示:
CH3OH(g) ΔH2,在10 L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示:

200 ℃时n(H2)随时间的变化如下表所示:
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
①ΔH2____(填“>”“<”或“=”)0。
②写出两条可同时提高反应速率和CO转化率的措施:_____。
③下列说法正确的是____(填字母)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强:p1<p2
④0~3 min内用CH3OH表示的反应速率v(CH3OH)=____mol·L-1·min-1。
⑤200 ℃时,该反应的平衡常数K=____。向上述200 ℃达到平衡的恒容密闭容器中再加入2 mol CO、4 mol H2、2 mol CH3OH,保持温度不变,则化学平衡____(填“正向”“逆向”或“不”)移动。
(3)甲烷、氧气和KOH溶液可组成燃料电池。标准状况下充入5.6 L甲烷,测得电路中转移1.2 mol电子,则甲烷的利用率为____。