题目内容
【题目】根据最新报道,贵州发现超大型锰矿,整个矿区资源量超两亿吨。锰矿是继铁矿、铝矿之后,排在第三位的金属矿产,属国家战略紧铁矿产之一,在电池、磁性新材料等方面都有广泛应用。中国是全球最大的锰矿石和锰系材料生产、清费大国,回答下列问题:
(1)基态锰原子的价层电子排布式为_________。
(2)铜锰氧化物(CuMn2O4) 能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
①CO 和N2 互为等电于体。CO 分子中σ键和π键数目之比为________。
②HCHO分子的H-C-H 键角______(填“大于”“小于”或“等于”)CO2的键角,理由是__________。
③ 向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶被中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。CO32-的空间构型是____________。
(3)晶体熔点: Fe2O3晶体______Al2O3晶体(填“>”“<”或“=”),理由是___________。
(4)锰、铁的第三电离能(I3) 较大的是_______(填素符号)。
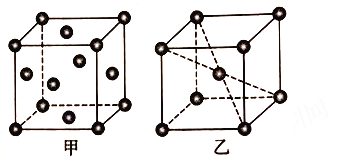
(5) 铝晶胞如图26甲所示。铝晶胞中,铝原子的配位数为________。已知铝的晶体密度为ρ g·cm-3,N A代表阿伏加德罗常数的值,设铝原子的半径为rpm,则r=_______。
(6)锰晶胞如图乙所示。已知锰晶胞参数为a nm。设锰晶胞中两个锰原子核之间最短距离为dnm,则d=_____。锰晶胞中Mn 的空间利用率φ=____________。
【答案】 3d54s2 1︰2 小于 HCHO中C为sp2杂化,CO2中C为sp杂化 < 平面三角形 氧化铝、氧化铁都是离子晶体,铝离子半径小于铁离子,氧化铝的晶格能较大 Mn 12 ![]()
![]()
![]()
【解析】(1)锰是25号元素,3d和4s上的电子是其价电子,根据构造原理知其价电子排布式为:3d54s2 ;(2)①CO与N2结构相似,CO分子中σ键与π键数目之比为1:2;②HCHO中C为sp2杂化,CO2中C为sp杂化,在中心原子无孤对电子的情况下,sp杂化键角为180°,sp2杂化键角为120°,故HCHO分子的H-C-H键角小于CO2的键角;③CO32-中C原子形成3个δ键,没有孤电子对,则应为平面三角形;(3)氧化铝、氧化铁都是离子晶体,铝离子半径小于铁离子,氧化铝的晶格能较大,故晶体熔点:Fe2O3晶体<Al2O3晶体;(4)铁、锰的价电子排布式分别为3d64s2、3d54s2,当锰失去2e后3d轨道为半满,所以失去第三个电子所需的能量高,故锰、铁的第三电离能(I3)较大的是Mn;(5)铝为面心立方最密堆积,配位数为12;设晶胞边长为![]() ,面对角线(即4个原子半径)
,面对角线(即4个原子半径)![]() ,
,![]() ,根据
,根据![]() ,
,![]() ;(6)设锰原子的半径为
;(6)设锰原子的半径为![]() nm,体对角线(即4个原子半径)
nm,体对角线(即4个原子半径)![]() ,
, ![]() ,两原子核间最短距离是顶角到体心的距离(即2个原子半径),
,两原子核间最短距离是顶角到体心的距离(即2个原子半径),![]() 。锰晶胞中锰的空间利用率等于两个锰原子的体积除以立方体的体积,即
。锰晶胞中锰的空间利用率等于两个锰原子的体积除以立方体的体积,即![]() (或68%)。
(或68%)。

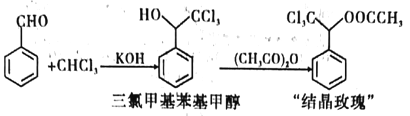
【题目】“结晶玫瑰”是具有强烈玫瑰香气的结晶型固体香料,在香料和日用化工产品中具有广阔的应用价值。其化学名称为“乙酸三氯甲基苯甲酯”,目前国内工业上主要使用以下路径来合成结晶玫瑰:
I.由苯甲醛和氯仿合成三氯甲基苯基甲醇。
Ⅱ.三氯甲基苯基甲醇与乙酸酐发生乙酰化反应制得“结晶政瑰”。
已知:
三氯甲基苯基甲醇 | 相对分子质量:225.5。无色液体。不溶于水,密度比水大,溶于乙醇 |
乙酸酐 | 无色液体。与水反应生成乙酸,溶于乙醇 |
“结晶玫瑰” | 相对分子质量:267.5。白色晶体。熔点:88℃。不溶于水,溶于乙醇 |
具体实验步骤如下:
I.由苯甲醛和氯仿合成三氯甲基苯基甲醇。
步骤一:装置如图所示。依次将苯甲醛、氯仿加入三颈烧瓶中,仪器A中加入KOH和助溶剂。滴加A中试剂并搅拌,开始反应并控制在一定温度下进行。

步骤二:反应结束后,将混合物依次用5%的盐酸、蒸馏水洗涤。
步骤三:将洗涤后的混合物蒸馏,除去其他有机杂质,加无水琉酸镁,过滤。滤液即为粗制三氯甲基萃基甲醇。
Ⅱ.三氯甲基苯基甲醇与乙酸酐发生乙酰化反应制得“结晶玫瑰”。
步骤四:向另一三颈瓶中加入制备的三氯甲基苯基甲醇、乙酸酐,并加入少量浓硫酸催化反应,加热控制反应温度在90℃~110℃之间。
步骤五:反应完毕后,将反应液倒入冰水中,冷却结晶获得“结晶玫瑰”。
请回答下列问题:
(1)仪器A的名称是_________。实验装置B中,冷凝水应从_____口进(填“a”或“b”)。
(2)步骤二中,用5%的盐酸洗涤的主要目的是___________。在洗涤、分液操作中,应充分振荡,然后静置,待分层后有机层应___________ (填序号)。
A.直接从上口倒出
B.先将水层从上口倒出,再将有机层从下口放出
C.直接从下口放出
D.先将水层从下口放出,再将有机层从下口放出
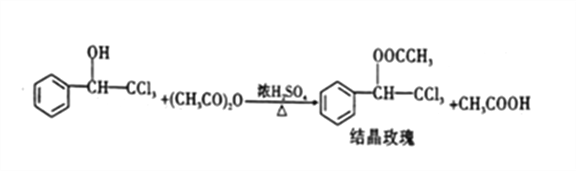
(3)步骤三中,加入无水硫酸镁的目的是___________。若未加入无水硫酸镁,直接将蒸馏所得物质进行后续反应,会使“结晶玫瑰”的产率偏______(填“高”或“低”),其原因是___________ (利用平衡移动原理解释)。(已知Ⅱ的具体反应如图所示)
(4)步骤四中,加料时,应先加入三氯甲基苯基甲醇和乙酸酐,然后慢慢加入浓硫酸并搅拌,主要是为了__________。加热反应时,为较好的控制温度,最适宜的加热方式为_____(填“水浴加热”或“油浴加热”)。
(5)22.55g三氟甲基苯基甲醇与足量乙酸酐充分反应得到结晶玫瑰21.40g,则产率是_____。