题目内容
【题目】碳族、氮族元素及其化合物在生产、生活和环境保护中应用广泛。
(1)下列有关物质性质递变的描述中,正确的是________________(填代号)。
A.酸性:HNO3>H2CO3>H2SiO3 B.稳定性:NH3>AsH3>PH3
C.稳定性:N2<P4(白磷) D.常温下,同浓度溶液的pH:Na3PO4<Na3AsO4
(2)已知:
(a)CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3 kJ·mol1
(b)2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ·mol1
(c)C(s)+O2(g)=CO2(g) ΔH3=-393.5 kJ·mol1
①C(s)+2H2(g)=CH4(g) ΔH=___________kJ·mol1。
②CH4制备合成气的原理是CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
A. 下列叙述不能表示该反应在恒温恒容条件下达到平衡状态的是____。
a. 混合气体的压强不再发生变化
b. 混合气体的密度不再发生变化
c. 反应容器中CO2、CO的物质的量的比值不再发生变化
d. 混合气体的平均相对分子质量不再发生变化
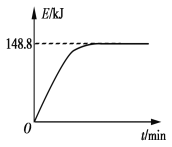
B. 若1 g CH4(g)完全反应吸收热量为15.5 kJ。在恒容密闭容器中充入1 mol CH4和1 mol CO2在一定条件下反应,体系吸收热量随着时间变化如图所示。在该条件下,甲烷的最大转化率(α)为____________。
(3)在密闭容器中发生反应:2NO(g)+H2(g)= N2(g)+2H2O(g),其反应速率与浓度关系式为v=kcm(NO)·cn(H2)(k为常数,只与温度有关,m、n为反应级数,取正整数),在某温度下测得有关数据如表所示。
序数 | c(NO)/(mol·L1) | c(H2)/(mol·L1) | v/(mol·L1·min1) |
Ⅰ | 0.10 | 0.10 | 0.414 |
Ⅱ | 0.20 | 0.20 | 3.312 |
Ⅲ | 0.10 | 0.20 | 0.828 |
总反应分两步进行:第i步,2NO+H2=N2+H2O2(很慢);第ii步,H2O2+H2![]() 2H2O(很快)。在上述温度下,当c(NO)=c(H2)=0.50 mol·L1时v=_________mol·L1·min1。
2H2O(很快)。在上述温度下,当c(NO)=c(H2)=0.50 mol·L1时v=_________mol·L1·min1。
(4)在2 L恒容密闭容器中充入3 mol NO(g)和3 mol CO(g),发生反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g),在一定温度下达到平衡,测得平衡体系中c(N2)=0.5 mol·L1。则该条件下平衡常数K值为_______。反应前后容器内气体压强之比为_________________________。
N2(g)+2CO2(g),在一定温度下达到平衡,测得平衡体系中c(N2)=0.5 mol·L1。则该条件下平衡常数K值为_______。反应前后容器内气体压强之比为_________________________。
【答案】AD -74.8 b 60% 51.75 8 6:5
【解析】
(1)非金属性越强,最高价的含氧酸的酸性越强,形成的气态氢化物越稳定,由此分析;
(2)已知:(a)CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3 kJ·mol1
(b)2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ·mol1
(c)C(s)+O2(g)=CO2(g) ΔH3=-393.5 kJ·mol1
①反应C(石墨,s)+2H2(g)=CH4(g)可以是b+ca得到,由此分析解答;
②A.可逆反应达到平衡状态,一定满足正逆反应速率相等,各组分的浓度、百分含量不再变化,据此进行判断;
B.依据①计算得到的反应的焓变,图中中是反应达到平衡状态时放热148.8KJ,计算反应的甲烷得到转化率;
(3)观察Ⅰ,Ⅱ,Ⅲ反应速率与浓度的关系,可以得出反应速率是一氧化氮浓度倍数的平方与氢气浓度倍数的乘积;据此可以求出反应速率;
(4) 根据三段式进行相关计算,根据反应前后容器内气体压强之比为等于物质的量之比,因为同一个容器,又等于物质的量浓度之比,即可求出压强之比。
(1)A.非金属性是氮大于碳,碳大于硅,所以最高价含氧酸的酸性是HNO3>H2CO3>H2SiO3,故A正确;
B.同一主族从上到下非金属性逐渐减弱,所以非金属性是氮大于磷,磷大于砷,非金属性越强,气态氢化物越稳定,NH3 >PH3>AsH3,故B错误;
C.稳定性:N2>P4(白磷),因为白磷易自然,而氮气性质稳定,很难发生反应,故C错误;
D.磷酸的酸性大于砷酸的酸性,利用越弱越水解,可得常温下,同浓度溶液的pH:Na3PO4<Na3AsO4,故D正确;
故选:AD。
(2)已知:(a)CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3 kJ·mol1
(b)2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ·mol1
(c)C(s)+O2(g)=CO2(g) ΔH3=-393.5 kJ·mol1
①盖斯定律计算,b+ca得到,反应C(石墨,s)+2H2(g)=CH4(g)△H=74.8kJmol1;
故答案为:74.8;
②A. a. 混合气体的压强不再发生变化,因为反应前后气体的体积不相等,混合气体的压强不再发生变化,说明气体的总物质的量不变,可逆反应处于平衡状态,可以判断可逆反应处于平衡状态,故a错误;
b. 混合气体的密度不变,反应前后都是气体,容器的容积不变,所以气体的密度始终不变,密度不能作为判断平衡状态的依据,故b正确;
c. 反应容器中CO2、CO的物质的量的比值不再发生变化,可以判断可逆反应处于平衡状态,故错误;
c. 该反应是气体体积缩小的反应,反应过程中气体的物质的量发生变化,混合气体的平均分子量发生变化,若混合气体的平均相对分子质量不变,说明达到了平衡状态,故c错误;
故答案为:b。
B.甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气): CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g),1gCH4完全反应可释放15.46kJ的热量,计算1mol甲烷完全反应放出的热量=15.46KJ×16=247.36KJ,反应焓变△H=247.36KJ/mol,反应为放热反应,反应物能量高于生成物,反应的热化学方程式为:CH4(g)+CO2(g)
2CO(g)+2H2(g),1gCH4完全反应可释放15.46kJ的热量,计算1mol甲烷完全反应放出的热量=15.46KJ×16=247.36KJ,反应焓变△H=247.36KJ/mol,反应为放热反应,反应物能量高于生成物,反应的热化学方程式为:CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g);△H=247.36KJ/mol,图象可知反应达到平衡状态放出热量148.80KJ,则反应的甲烷物质的量
2CO(g)+2H2(g);△H=247.36KJ/mol,图象可知反应达到平衡状态放出热量148.80KJ,则反应的甲烷物质的量![]() =0.60,甲烷转化率为60%;
=0.60,甲烷转化率为60%;
故答案为:60%;
(3)观察Ⅰ,Ⅱ,Ⅲ反应速率与浓度的关系,可以得出反应速率是一氧化氮浓度倍数的平方与氢气浓度倍数的乘积,当c(NO)=c(H2)=0.50 mol·L1时,一氧化氮的浓度变为原来的五倍,氢气的浓度是原来的五倍,故v=52×5×0.414=51.75;
故答案为:51.75;
(4) 2NO(g) +2CO(g) ![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
初始浓度:(mol/L) 1.5 1.5 0 0
变化浓度:(mol/L) 1.0 1.0 0.5 1.0
平衡浓度:(mol/L) 0.5 0.5 0.5 1.0
K= 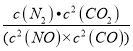 =
=![]() =8,反应前后容器内气体压强之比为等于物质的量之比,因为同一个容器,又等于物质的量浓度之比,即是:(1.5+1.5):(0.5+0.5+0.5+1.0)=6:5;
=8,反应前后容器内气体压强之比为等于物质的量之比,因为同一个容器,又等于物质的量浓度之比,即是:(1.5+1.5):(0.5+0.5+0.5+1.0)=6:5;
故答案为:8;6:5。

 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案【题目】在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) ![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(X) | n(Y) | n(M) | |||
① | 700 | 0.40 | 0.10 | 0.090 | |
② | 800 | 0.10 | 0.40 | 0.080 | |
③ | 800 | 0.20 | 0.30 | a | |
④ | 900 | 0.10 | 0.15 | b | |
下列说法正确的是( )
A. 实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol·L-1·min-1
B. 实验②中,该反应的平衡常数K=2.0
C. 实验③中,达到平衡时,X的转化率为60%
D. 实验④中,达到平衡时,b>0.060
【题目】利用如图所示装置进行下列实验,不能得出相应实验结论的是

选项 | ① | ② | ③ | 实验结论 |
A | 稀硫酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:S>C>Si |
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 |
C | 浓硝酸 | Fe | NaOH溶液 | 说明铁和浓硝酸反应可生成NO2 |
D | 浓氨水 | 生石灰 | 酚酞 | 氨气的水溶液呈碱性 |
A.AB.BC.CD.D