题目内容
【题目】下列说法正确的是( )
A.金属的晶胞如图所示 ,其配位数为8
,其配位数为8
B.![]() 分子中,S原子的价层电子对数为3,中心原子上孤电子对数为1,S原子为
分子中,S原子的价层电子对数为3,中心原子上孤电子对数为1,S原子为![]() 杂化,是直线型分子
杂化,是直线型分子
C.醋酸钠溶液中离子浓度的关系为:![]()
D.已知反应![]() ,某温度下的平衡常数为400,此温度下,在恒容密闭容器中加入一定量
,某温度下的平衡常数为400,此温度下,在恒容密闭容器中加入一定量![]() ,某时刻测得各组分浓度如表,则此时正、逆反应速率的大小关系为:
,某时刻测得各组分浓度如表,则此时正、逆反应速率的大小关系为:![]()
物质 |
|
|
|
浓度 |
|
|
|
【答案】D
【解析】
![]() 金属的晶胞如图所示
金属的晶胞如图所示 ,属于简单立方,配位数是6,故A错误;
,属于简单立方,配位数是6,故A错误;
B.SO2分子中,S原子的价层电子对数为3,中心原子上孤电子对数为1,有三对共用电子对,只接两个O,所以剩一对孤电子,S原子为![]() 杂化,是V型分子,故B错误;
杂化,是V型分子,故B错误;
C.酸根离子水解,溶液显碱性,显性离子大于隐性离子,则离子关系为![]() ,故C错误;
,故C错误;
D.此时浓度商![]() ,反应未达到平衡状态,向正反应方向移动,故
,反应未达到平衡状态,向正反应方向移动,故![]() ,故D正确;
,故D正确;
答案选D。

 阅读快车系列答案
阅读快车系列答案【题目】碳族、氮族元素及其化合物在生产、生活和环境保护中应用广泛。
(1)下列有关物质性质递变的描述中,正确的是________________(填代号)。
A.酸性:HNO3>H2CO3>H2SiO3 B.稳定性:NH3>AsH3>PH3
C.稳定性:N2<P4(白磷) D.常温下,同浓度溶液的pH:Na3PO4<Na3AsO4
(2)已知:
(a)CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3 kJ·mol1
(b)2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ·mol1
(c)C(s)+O2(g)=CO2(g) ΔH3=-393.5 kJ·mol1
①C(s)+2H2(g)=CH4(g) ΔH=___________kJ·mol1。
②CH4制备合成气的原理是CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
A. 下列叙述不能表示该反应在恒温恒容条件下达到平衡状态的是____。
a. 混合气体的压强不再发生变化
b. 混合气体的密度不再发生变化
c. 反应容器中CO2、CO的物质的量的比值不再发生变化
d. 混合气体的平均相对分子质量不再发生变化
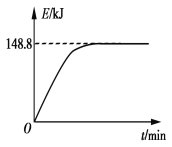
B. 若1 g CH4(g)完全反应吸收热量为15.5 kJ。在恒容密闭容器中充入1 mol CH4和1 mol CO2在一定条件下反应,体系吸收热量随着时间变化如图所示。在该条件下,甲烷的最大转化率(α)为____________。
(3)在密闭容器中发生反应:2NO(g)+H2(g)= N2(g)+2H2O(g),其反应速率与浓度关系式为v=kcm(NO)·cn(H2)(k为常数,只与温度有关,m、n为反应级数,取正整数),在某温度下测得有关数据如表所示。
序数 | c(NO)/(mol·L1) | c(H2)/(mol·L1) | v/(mol·L1·min1) |
Ⅰ | 0.10 | 0.10 | 0.414 |
Ⅱ | 0.20 | 0.20 | 3.312 |
Ⅲ | 0.10 | 0.20 | 0.828 |
总反应分两步进行:第i步,2NO+H2=N2+H2O2(很慢);第ii步,H2O2+H2![]() 2H2O(很快)。在上述温度下,当c(NO)=c(H2)=0.50 mol·L1时v=_________mol·L1·min1。
2H2O(很快)。在上述温度下,当c(NO)=c(H2)=0.50 mol·L1时v=_________mol·L1·min1。
(4)在2 L恒容密闭容器中充入3 mol NO(g)和3 mol CO(g),发生反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g),在一定温度下达到平衡,测得平衡体系中c(N2)=0.5 mol·L1。则该条件下平衡常数K值为_______。反应前后容器内气体压强之比为_________________________。
N2(g)+2CO2(g),在一定温度下达到平衡,测得平衡体系中c(N2)=0.5 mol·L1。则该条件下平衡常数K值为_______。反应前后容器内气体压强之比为_________________________。