题目内容
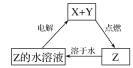
【题目】常温下,0.2mol/L一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是

A. HA是强酸
B. 该混合液pH=7
C. 图中x表示HA,Y表示OH-,Z表示H+
D. 该混合溶液中:c(A-)+c(Y)=c(Na+)
【答案】D
【解析】
试题A、0.2mol/L一元酸HA与等浓度的NaOH溶液等体积混合后,得到的溶液为0.1mol/L的NaA溶液,若HA为强酸,则溶液为中性,且c(A-)=0.1mol/L,与图不符,所以HA为弱酸,A错误;B、根据A的分析,可知该溶液的pH>7,错误;C、A-水解使溶液显碱性,所以溶液中的粒子浓度的大小关系是c(Na+)> c(A-)>c(OH-)>c(HA)> c(H+),所以X是OH-,Y是HA,Z表示H+,错误;D、根据元素守恒,有c(A-)+c(HA)=c(Na+),正确,答案选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】近年来,中国华北华中地区发生了严重的雾霾天气。汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因。
(1)汽车尾气净化的主要原理为2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) △H<0,在一定温度下,在一体积恒定的密闭容器中充入一定量的NO(g)和CO(g)在t1时刻达到平衡状态。若要同时提高该反应的速率和NO(g)的转化率,可采取的措施_______________。(写一条)
N2(g)+2CO2(g) △H<0,在一定温度下,在一体积恒定的密闭容器中充入一定量的NO(g)和CO(g)在t1时刻达到平衡状态。若要同时提高该反应的速率和NO(g)的转化率,可采取的措施_______________。(写一条)
(2)改变煤的利用方式可减少环境污染,通常可将煤气化转化为水煤气,其反应原理为:C(s)+H2O(g)![]() CO(g)+H2(g) ; △H=+131.3kJ/mol。
CO(g)+H2(g) ; △H=+131.3kJ/mol。
①该反应在_________下能自发进行(填“高温”或“低温”)。
②水煤气燃烧过程中产生的CO2气体可以与“84消毒液”的主要成分NaClO发生反应,该反应的离子方程式为:___________________________________________________。(已知:HClO:Ka=3.0×10ˉ8;H2CO3:Ka1=4.30×10ˉ7;Ka2=5.61×10ˉ11)
(3)已知反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
实验 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | |
CO | H2O | H2 | |||
1 | 650 | 4 | 2 | 1.6 | 6 |
2 | 900 | 2 | 1 | 0.4 | 3 |
3 | 900 | a | b | c | t |
①实验1条件下平衡常数K=________________(保留小数点后二位)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是______。
③该反应的△H ____0(填“<”或“>”);若900℃时,另做一组实验,在此容器中加入10molCO,5mo1H2O,2mo1CO2,5molH2,此时v(正) ___v(逆)
【题目】燃煤的烟气中含有 SO2,为了治理雾霾天气,工厂采用多种方法实现烟气脱硫。
Ⅰ.(1)“湿式吸收法”利用吸收剂与 SO2 发生反应从而脱硫。下列试剂中适合用作该法吸收剂的是_____(填字母序号)。
a. 石灰乳 b.CaCl2溶液
(2)某工厂利用含 SO2 的烟气处理含Cr2O72-的酸性废水,吸收塔中反应后的铬元素以Cr3+形式存在,具体流程如下:

①用 SO2 处理含铬废水时,利用了 SO2 的_____性。
②吸收塔中发生反应的离子方程式为_____。
Ⅱ.石灰-石膏法和烧碱法是常用的烟气脱硫法。石灰-石膏法的吸收反应为Ca(OH)2+SO2= CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O =2CaSO4·2H2O。其流程如图:

烧碱法的吸收反应为2NaOH+SO2=Na2SO3+H2O。该法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如图:

已知:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.9 |
吸收 SO2 的成本(元/mol) | 0.027 | 0.232 |
(3)石灰-石膏法和烧碱法相比,石灰-石膏法的优点是_______,缺点是_______。
(4)某学习小组在石灰-石膏法和烧碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案,流程图中的甲、乙、丙各是_____、_____、_____(填化学式)