题目内容
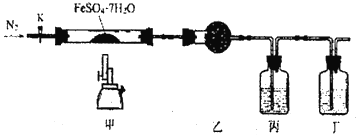
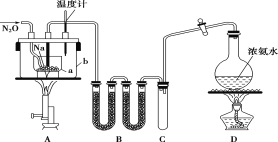
【题目】叠氮化钠(NaN3)常用作汽车安全气囊中的药剂。实验室制取叠氮化钠的原理、实验装置及实验步骤如下:
①打开装置D导管上的旋塞,加热制取氨气。
②再加热装置A中的金属钠,使其熔化并充分反应后,再停止加热装置D并关闭旋塞。
③向装置A中b容器内充入加热介质并加热到210~220℃,然后通入N2O。
④冷却,向产物中加入乙醇(降低NaN3的溶解度),减压浓缩结晶后,再过滤,并用乙醚洗涤,晾干。
已知:I.NaN3是易溶于水的白色晶体,微溶于乙醇,不溶于乙醚;
II.NaNH2熔点210℃,沸点400℃,在水溶液中易水解。
请回答下列问题:
(1)装置B中盛放的药品为______。
(2)步骤①中先加热通氨气的目的是_______________;步骤②氨气与熔化的钠反应生成NaNH2的化学方程式为__________;步骤③中最适宜的加热方式为 ______(填“水浴加热”,“油浴加热”)。
(3)生成NaN3的化学方程式为 _______。
(4)图中仪器a用的是铁质而不用玻璃,其主要原因是_____。
(5)步骤④中用乙醚洗涤的主要目的是_______。
(6)实验室用滴定法测定叠氮化钠样品中NaN3的质量分数:①将2.500 g试样配成500.00 mL溶液。②取50.00 mL溶液置于锥形瓶中,加入50.00 mL 0.1010 mol·L-1(NH4)2Ce(NO3)6溶液。③充分反应后,将溶液稍稀释,向溶液中加入8 mL浓硫酸,滴入3滴邻菲啰啉指示液,用0.0500mol·L-1(NH4)2Fe(SO4)2标准溶液滴定过量的Ce4+,消耗溶液体积为29.00mL。测定过程的反应方程式为:2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑;Ce4++Fe2+=Ce3++Fe3+;试样中NaN3的质量分数为_______。
【答案】碱石灰(或氢氧化钠固体) 排尽装置中的空气防止空气中氧气等与钠发生反应 2Na+2NH3![]() 2NaNH2+H2 油浴加热 NaNH2+N2O
2NaNH2+H2 油浴加热 NaNH2+N2O![]() NaN3+H2O 反应过程中有水生成会与钠生成NaOH能腐蚀玻璃 NaN3不溶于乙醚,能减少NaN3的溶解损耗;且乙醚易挥发,有利于产品快速干燥 93.60%
NaN3+H2O 反应过程中有水生成会与钠生成NaOH能腐蚀玻璃 NaN3不溶于乙醚,能减少NaN3的溶解损耗;且乙醚易挥发,有利于产品快速干燥 93.60%
【解析】
(1)根据已知:NaN3是易溶于水,故制备过程不能有水的参与,据此分析;
(2)反应物钠与空气中二氧化碳和水反应,需排除装置内的空气;氨气与熔化的钠反应生成NaNH2和氢气;步骤③的温度为210~220℃,选择油浴加热;
(3)NaNH2和N2O价态归中得到NaN3,据此书写;
(4)a中有可能生成NaOH,会腐蚀玻璃;
(5)根据“NaN3是易溶于水的白色晶体,微溶于乙醇,不溶于乙醚”分析;
(6根据方程式和电子守恒进行计算。
(1)已知:NaN3易溶于水,所以在制备过程不能有水,D中制备的氨气含有水蒸气,用B装置盛放碱石灰(或氢氧化钠固体)干燥氨气;
(2)步骤①中先加热通氨气,排尽装置中的空气,防止空气中的水蒸气和二氧化碳进入与钠反应;氨气与熔化的钠反应生成NaNH2和氢气,反应为:2Na+2NH3![]() 2NaNH2+H2;已知步骤③的温度为210~220℃,故选择油浴加热;
2NaNH2+H2;已知步骤③的温度为210~220℃,故选择油浴加热;
(3)NaNH2和N2O生成NaN3的反应为:NaNH2+N2O![]() NaN3+H2O;
NaN3+H2O;
(4)a中有可能生成NaOH,会腐蚀玻璃,故仪器a用的是铁质而不用玻璃;
(5)由题可知,NaN3不溶于乙醚,能减少NaN3的溶解损耗;且乙醚易挥发,有利于产品快速干燥,故用乙醚洗涤产品;
(6)(NH4)2Ce(NO3)6的总的物质的量n[(NH4)2Ce(NO3)6]=0.1010mol/L×0.050L=0.00505mol,部分与叠氮化钠反应,剩余的(NH4)2Ce(NO3)6用(NH4)2Fe(SO4)2标准溶液滴定,根据已知反应:Ce4++Fe2+=Ce3++Fe3+,参与反应的(NH4)2Ce(NO3)6与标准液的物质的量相等,为:0.0500mol/L×0.0290L=0.00145mol,故与叠氮化钠反应的(NH4)2Ce(NO3)6有0.00505mol-0.00145mol=0.0036mol,根据反应有:NaN3~(NH4)2Ce(NO3)6,则2.500g试样中叠氮化钠的质量为:0.0036mol×65g/mol×![]() =2.34g,所以试样中NaN3的质量分数为
=2.34g,所以试样中NaN3的质量分数为![]() ×100%=93.60%。
×100%=93.60%。