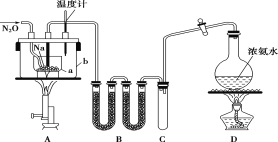
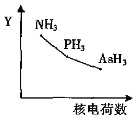
题目内容
【题目】某稀溶液中含有3.5 mol KNO3和2.2 mol H2SO4,向其中加入1.2 mol Fe,充分反应(已知NO![]() 被还原为NO)。下列说法正确的是
被还原为NO)。下列说法正确的是
A.反应过程中转移的电子数3NA
B.反应后生成NO的体积为24.64 L
C.所得溶液中c(Fe2+)∶c(Fe3+)=1∶3
D.所得溶液中c(NO3-)=2.4 mol·L-1
【答案】C
【解析】
某稀溶液中含有3.5 mol KNO3和2.2 mol H2SO4,向其中加入1.2 mol Fe,充分反应(已知NO3-被还原为NO),先发生反应的离子方程式为
Fe + NO3- + 4H+ = Fe3+ + NO↑ + 2H2O
1.2mol 3.5mol 4.4mol
可见,氢离子消耗完,铁过量,消耗1.1 mol金属铁,1.1 mol NO3-,生成1.1 mol Fe3+,1.1 mol NO气体,铁还剩余0.1 mol,铁又和铁离子反应,Fe + 2Fe3+==3Fe2+,因此0.1 mol铁消耗0.2 mol Fe3+,生成0.3 mol Fe2+。
A选项,1.1 mol NO3-反应转移电子数3.3NA,故A错误;
B选项,无标准状况条件,无法计算反应生成的NO的体积,故B错误;
C选项,生成0.3 mol Fe2+,0.9 mol Fe3+,所得溶液中c(Fe2+)∶c(Fe3+)=1∶3,故C正确;
D选项,所得溶液中剩余n(NO3-)=2.4 mol,溶液体积未知,无法计算c(NO3-),故D错误;
综上所述,答案为C。

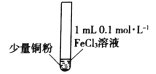
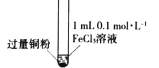
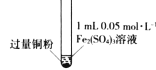
【题目】某小组同学通过实验研究FeCl3溶液与Cu粉发生的氧化还原反应。实验记录如下:
序号 | I | II | III |
实验步骤 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
实验现象 | 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 | 铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 | 铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀 |
下列说法不正确的是
A. 实验I、II、III中均涉及Fe3+被还原
B. 对比实验I、II说明白色沉淀的产生与铜粉的量有关
C. 实验II、III中加入蒸馏水后c(Cu2+)相同
D. 向实验III反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀