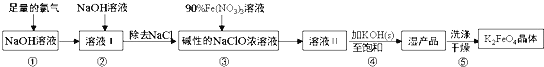
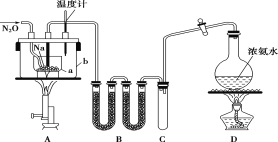
题目内容
【题目】将13.6gCu和Cu2O组成的混合物加入250 mL一定浓度的稀硝酸中,固体完全溶解生成Cu(NO3)2和NO。向所得溶液中加入1.0 L 0.5 molL-1的NaOH溶液,生成沉淀的质量为19.6 g,此时溶液呈中性,且金属离子(钠离子除外)沉淀完全。下列说法正确的是( )
A.原固体混合物中,Cu和Cu2O的物质的量之比为1:1
B.原稀硝酸的浓度为2.4 mol·L-1
C.固体溶解后剩余硝酸的物质的量为0.05 mol
D.产生的NO的体积为2.24L
【答案】B
【解析】
向所得溶液中加入0.5mol/L的NaOH溶液1L,溶液呈中性,金属离子已完全沉淀,此时溶液中溶质为NaNO3,n(NaNO3)=n(NaOH)=0.5mol/L×1L=0.5mol,沉淀为Cu(OH)2,质量为19.6g,其物质的量为n[Cu(OH)2]=19.6g÷98g/mol=0.2mol,根据铜元素守恒有n(Cu)+2n(Cu2O)= n[Cu(OH)2],所以反应后的溶液中n[[Cu(NO3)2]=n[Cu(OH)2]=0.2mol。
A.设Cu和Cu2O的物质的量分别为xmol、ymol,根据二者质量有64x+144y=13.6,根据铜元素守恒有x+2y=0.2,联立方程解得x=0.1,y=0.05,则:n(Cu):n(Cu2O)=0.1mol:0.05mol=2:1,A错误;
B.根据N元素守恒可知n(HNO3)=n(NO)+n(NaNO3),根据电子转移守恒可知:3n(NO)=2n(Cu)+2n(Cu2O),所以3n(NO)=2×0.1mol+2×0.05mol,解得n(NO)=0.1mol,根据Na元素可知n(NaNO3)=n(NaOH)=0.5mol/L×1L=0.5mol,所以n(HNO3)=n(NO)+n(NaNO3)=0.1mol+0.5mol=0.6mol,所以原硝酸溶液的浓度为c(HNO3)=![]() =2.4mol/L,B正确;
=2.4mol/L,B正确;
C.反应后的溶液中加入氢氧化钠溶液,氢氧化钠与硝酸铜反应,剩余的氢氧化钠与硝酸反应,最后为硝酸钠溶液,根据氮元素守恒可知反应后溶液中n(HNO3)+2n[[Cu(NO3)2]=n(NaNO3),所以n(HNO3)= n(NaNO3)-2n[[Cu(NO3)2]=0.5mol-2×0.2mol=0.1mol,C错误;
D.由B中计算可知n(NO)=0.1mol,所以标准状况下NO的体积V(NO)=0.1mol×22.4L/mol=2.24L,D错误;
故合理选项是B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
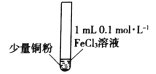
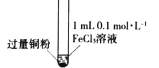
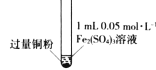
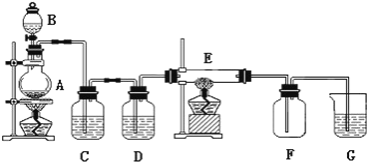
小学生10分钟应用题系列答案【题目】某小组同学通过实验研究FeCl3溶液与Cu粉发生的氧化还原反应。实验记录如下:
序号 | I | II | III |
实验步骤 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
实验现象 | 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 | 铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 | 铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀 |
下列说法不正确的是
A. 实验I、II、III中均涉及Fe3+被还原
B. 对比实验I、II说明白色沉淀的产生与铜粉的量有关
C. 实验II、III中加入蒸馏水后c(Cu2+)相同
D. 向实验III反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀