题目内容
【题目】分枝酸可用于生化研究,其结构简式如图。下列关于分枝酸的叙述不正确的是( )
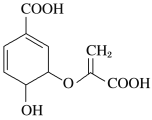
A. 分子中含有4种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1 mol 分枝酸最多可与2 mol NaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
【答案】D
【解析】
A.在该物质分子中含有羟基、羧基、碳碳双键、醚键四种官能团,A正确;
B.该物质含有羧基,可以与醇羟基发生酯化反应;含有羟基,可以与羧基发生酯化反应,二者的反应类型为酯化反应,也属于取代反应,B正确;
C.该物质分子中含有2个羧基可以与NaOH发生中和反应,C正确;
D.该物质含有碳碳双键,可以与溴的四氯化碳溶液发生加成反应,而使溶液褪色;碳碳双键能被酸性高锰酸钾溶液氧化而使其褪色,原理不同,D错误;
因此合理选项是D。

【题目】—氯甲烷是一种重要的化工原料,常温下它是无色有毒气体,微溶于水,易溶于乙醇、CCl4等。
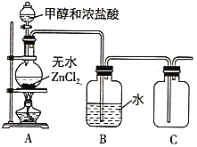
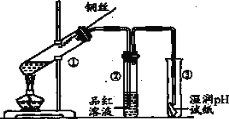
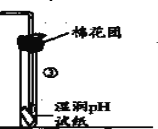
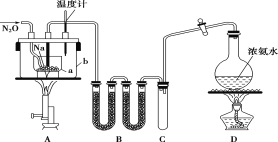
(1)某小组同学在实验室用如图所示装置模拟催化法制备和收集一氯甲烷。
①装置B的主要作用是_____。
②以无水ZnCl2为催化剂,圆底烧瓶中发生反应的化学方程式为____。如果实验时圆底烧瓶加热时间过长,最终在瓶底得到一种白色物质,该物质的化学式是____。
③收集到的CH3Cl气体在氧气中充分燃烧,产物用过量的V1mLc1mol/LNaOH溶液充分吸收,以甲基橙作指示剂,用c2mol/L盐酸标准液对吸收液进行滴定,最终消耗V2mL盐酸,则所收集CH3Cl的物质的量为_____mol。(已知:2CH3Cl+3O2=2CO2+2H2O+2HCl)
(2)查阅资料可知:AgNO3的乙醇溶液可以检验CH3X中的卤素原子。相关数据如下表:
化学键 | C-Cl | C-Br |
键能/(kJ·mol-1) | 330 | 276 |
化合物 | AgCl | AgBr |
Ksp | 1.8×10-10 | 5×10-13 |
①CH3X通入AgNO3的乙醇溶液中,除有沉淀生成外,还生成硝酸甲酯,请写出硝酸甲酯的结构简式:_____。
②设计实验证明HBr是强酸:____(简要说明实验操作、现象和结论)
③CH3Cl和CH3Br的混合气体通入AgNO3的乙醇溶液中,先出现淡黄色沉淀。请依据表中的键能和Ksp数据解释原因:____。