题目内容
18. 研究氮机器化合物对化工生产有重要意义.
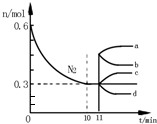
研究氮机器化合物对化工生产有重要意义.工业合成氨的原理为N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.如图表示在2L的恒容密闭容器中反应时N2的物质的量随时间的变化.
(1)图中0~10min内,用H2表示该反应的平均反应速率为0.045•L-1•min-1,从11min其其他条件不变,压缩容器的体积至1L,则n(N2)的变化曲线为d(填字母);
(2)下表为不同温度下(其他条件相同)该反应的平衡常数,由此可推知,三种温度下,反应从开始至达到平衡时所需时间最长的是T1(填“T1”“T2”或“T3”)
| T/℃ | T1 | T2 | T3 |
| K | 10 | 2.5 | 1.8 |
分析 (1)根据v=$\frac{△c}{△t}$计算v(N2),再利用反应速率之比等于其化学计量数之比计算v(H2);
11min压缩体积,瞬间各组分的物质的量不变,而压强增大,平衡向正反应移动,平衡时氮气的物质的量小于原平衡;
(2)正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小,据此判断温度高低,温度越低,反应速率越慢,到达平衡时间越长;
(3)根据平衡常数计算平衡时氮气的浓度,若要使平衡建立过程中NH3的浓度逐渐减小,即平衡向逆反应分析进行,则氮气的浓度应小于平衡浓度.
解答 解:(1)由图2可知,0~10min内氮气的物质的量变化量为0.6mol-0.3mol=0.3mol,v(N2)=$\frac{\frac{0.3mol}{2L}}{10min}$=0.015mol/(L•min),由于反应速率之比等于化学计量数之比,故v(H2)=3v(N2)=3×0.015mol/(L•min)=0.045mol/(L•min);
11min压缩体积,瞬间各组分的物质的量不变,压强增大,平衡向正反应移动,平衡时氮气的物质的量小于原平衡,故n(N2)的变化曲线为d,
故答案为:0.045;d;
(2)正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小,故温度T1<T2<T3,温度越低,反应速率越慢,到达平衡时间越长,即温度T1达到平衡时间最长,
故答案为:T1;
(3)若处于平衡时,由平衡常数可知:$\frac{0.{1}^{2}}{x×0.{1}^{3}}$=10,解得x=1,若要使平衡建立过程中NH3的浓度逐渐减小,即平衡向逆反应分析进行,则氮气的浓度应小于1mol/L,即0≤x<1,
故答案为:0≤x<1.
点评 本题考查物质的量随时间变化曲线、化学反应速率计算、外界条件对平衡移动影响、平衡常数影响因素及应用,题目难度中等,注重对常考知识点的考查,能较好的体现学生分析解答问题的能力.

 综合自测系列答案
综合自测系列答案| A. | 0.4mol•L-1 | B. | 0.3mol•L-1 | C. | 0.2mol•L-1 | D. | 0.1mol•L-1 |
| A. | 烷烃的沸点随碳原子数增加而逐渐升高 | |
| B. | 任何烷烃分子中碳氢原子个数比都是相同的 | |
| C. | 丙烷与Cl2发生取代反应后生成的一氯代物不只是一种 | |
| D. | 正丁烷的熔点、沸点比异丁烷的高 |
 中国最新战机歼-31使用了高强度、耐高温的钛合金材料.工业上冶炼钛的反应如下:TiCl4+2Mg=Ti+2MgCl2.下列有关该反应的说法正确的是( )
中国最新战机歼-31使用了高强度、耐高温的钛合金材料.工业上冶炼钛的反应如下:TiCl4+2Mg=Ti+2MgCl2.下列有关该反应的说法正确的是( )| A. | TiCl4是还原剂 | |
| B. | 每消耗1mol Mg,Mg得到2mol电子 | |
| C. | TiCl4发生氧化反应 | |
| D. | 为防止Mg、Ti被氧化该反应可在氩气流中进行 |

(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol相关数据如下
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2(g)和3molH2(g) | 1molCH3OH和1molH2O(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时能量变化 | 放出29.4kJ | 吸收akJ |
②若甲中反应10s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是0.03mol)L.s)
(2)压强为p1时,向体积为1L密闭容器中充入bmolCO和2bmolH2,发生反应CO(g)+2H2(g)?CH3OH(g)
,平衡时CO的转化率与温度、压强的关系如图1所示,请回答:
①该反应属于放(填“吸”或“放”)热反应,p1<p2(填“>”“<”或“=”)
②100℃时,该反应的平衡常数K=$\frac{1}{{b}^{2}}$(用含b的代数式表示)
(3)治理汽车尾气的反应是2NO(g)+2CO(g)?2CO2+N2(g)在常温下能够自发进行,则它的△H<0.(填>、<).在恒温容的密闭容器中通入n(NO):n(CO)=1:2的混合气体,发生上述反应,下列图象说明反应在进行到t1时刻一定达到平衡状态的是cd(选填字母)
| A. | 酸性 HClO4>HBrO4>HIO4 | B. | 碱性 Ba(OH)2>Ca(OH)2>Mg(OH)2 | ||
| C. | 非金属性 F>Cl>Br | D. | 稳定性 HCl>H2S>PH3 |
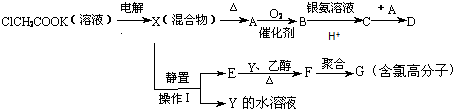
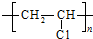 .
. .
.