题目内容
5.为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是铁钉遇冷浓硫酸在表面形成致密的氧化膜.
(2)取铁钉6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y.
①甲同学认为X中除Fe3+外还可能含有Fe2+.若要确认其中的Fe2+,应选用下列试剂中的d ( 选填序号)进行实验分析.
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取经干燥过的气体Y336ml(标准状况)通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g.由于此推知气体Y中H2的体积分数为33.3%.
分析 (1)铁钉(碳素钢)放入冷浓硫酸中,浓硫酸有较强的氧化性能使铁钉钝化;
(2)①利用+2价亚铁离子能使酸化的高锰酸钾褪色来检验;
②生成的SO2具有还原性,通入足量溴水中发生反应:SO2+Br2+2H2O=2HBr+H2SO4,利用硫元素的守恒并结合关系式:SO2→BaSO4求出SO2的物质的量,从而得出氢气的物质的量,再计算出氢气的体积分数.
解答 解:(1)铁钉(碳素钢)放入冷浓硫酸中,浓硫酸有较强的氧化性,铁钉遇冷浓硫酸在表面形成致密的氧化膜,阻止反应进一步进行,
故答案为:铁钉遇冷浓硫酸在表面形成致密的氧化膜;
(2)①+2价亚铁离子能使酸化的高锰酸钾褪色,a、b都不能检验亚铁离子,只有d能检验溶液中含有+2价铁离子,选c会生成两种沉淀,受氢氧化铁颜色的影响无法辨别,只能选d,
故答案为:d;
②SO2具有还原性,通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4,
标况下336mL混合气体的物质的量为:n(混合气体)=$\frac{0.336L}{22.4L/mol}$=0.015mol,
SO2→BaSO4
1mol 233g
n 2.33g
则:n=$\frac{1mol×2.33g}{233g}$=0.01mol,
则混合气体中氢气的物质的量为0.015mol-0.01mol=0.005mol,相同条件下气体的体积之比等于其物质的量之比,
故混合气体中H2的体积分数为:$\frac{0.005mol}{0.015mol}$×100%≈33.3%,
故答案为:33.3%.
点评 本题综合考查元素化合物知识、提出假设并设计实验方案的能力和文字表达能力,题目难度中等,试题开放性较强,涉及浓硫酸的强氧化性,C、S与Fe及其化合物的性质,注意熟练掌握浓硫酸的性质及性质实验方案的设计与评价原则.

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案①m-4 ②m+4 ③m+8 ④m-2 ⑤m+6.
| A. | ①②④⑤ | B. | ①②③⑤ | C. | ①②③④ | D. | ①②③④⑤ |
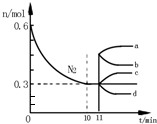 研究氮机器化合物对化工生产有重要意义.
研究氮机器化合物对化工生产有重要意义.工业合成氨的原理为N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.如图表示在2L的恒容密闭容器中反应时N2的物质的量随时间的变化.
(1)图中0~10min内,用H2表示该反应的平均反应速率为0.045•L-1•min-1,从11min其其他条件不变,压缩容器的体积至1L,则n(N2)的变化曲线为d(填字母);
(2)下表为不同温度下(其他条件相同)该反应的平衡常数,由此可推知,三种温度下,反应从开始至达到平衡时所需时间最长的是T1(填“T1”“T2”或“T3”)
| T/℃ | T1 | T2 | T3 |
| K | 10 | 2.5 | 1.8 |

已知吸收塔中反应后的铬元素以Cr3+形式存在,下列说法中正确的是( )
| A. | 吸收塔中的硫元素可能以单质形式存在 | |
| B. | 中和池中只发生生成沉淀的复分解反应 | |
| C. | 在中和池中加入盐酸酸化的BaCl2溶液,可能产生白色沉淀 | |
| D. | 由题意分析得到,沉淀可能是Cr(OH)6 |
| A. | 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性 | |
| B. | 浓硝酸在光照下颜色变黄,说明浓硝酸不稳定 | |
| C. | 常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应 | |
| D. | 浓硫酸常温下与铜不反应,加热时才能发生反应 |
 在某一容积为5L的密闭容器内,加入0.2mol的CO和0.2mol 的H2O(g),在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g)═CO2(g)+H2(g),反应放出热量.反应中CO2的浓度随时间变化的情况如图所示:
在某一容积为5L的密闭容器内,加入0.2mol的CO和0.2mol 的H2O(g),在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g)═CO2(g)+H2(g),反应放出热量.反应中CO2的浓度随时间变化的情况如图所示:
 天然气在生产、生活中具有广泛的应用.
天然气在生产、生活中具有广泛的应用.