题目内容
12.铁是目前用途最广,用量最大的金属.运用所学知识,回答下列问题.(1)鉴别Fe(OH)3胶体和FeCl3溶液的方法是用平行光照射两种分散系(或丁达尔现象).
(2)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:2Fe3++Cu=2Fe2++Cu2+.
(3)工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如下方案:

①滤渣C的化学式为Fe和Cu;
②试剂F宜选用B(填选项序号),通入F的目的是将溶液中的Fe2+转化为Fe3+;
A.酸性KMnO4溶液 B.氯水 C.溴水
(4)某研究性学习小组为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,则待测液中含有的金属阳离子是Fe3+、Fe2+、Cu2+;
②溶液组成的测定:取30.0mL待测溶液,加入足量的AgNO3溶液,得25.83g白色沉淀.则溶液中c(Cl-)=6.0mol/L.
分析 (1)胶体具有丁达尔效应,溶液没有丁达尔效应;
(2)氯化铁具有氧化性,能将Cu氧化为铜离子,而自身被还原为亚铁离子;
(3)废液中含有FeCl2、CuCl2,向废液中加入过量Fe,Fe置换出Cu,然后过滤,得到的滤渣C含有Fe和Cu,滤液B中含有FeCl2,向C中加入过量稀盐酸,Fe溶解生成FeCl2,铜不反应,然后过滤,得到的滤液中含有HCl、FeCl2,得到的滤渣为Cu;
将滤液B和E混合,将亚铁离子氧化为铁离子,且不能引进杂质,则F为氯水;
(4)①铁离子和KSCN溶液混合生成络合物而使溶液呈血红色;
②白色沉淀是AgCl,n(AgCl)=$\frac{25.83g}{143.5g/mol}$=0.18mol,根据Cl原子守恒得n(Cl-)=n(AgCl)=0.18mol,溶液中c(Cl-)=$\frac{n}{V}$.
解答 解:(1)胶体具有丁达尔效应,溶液没有丁达尔效应,所以鉴别Fe(OH)3胶体和FeCl3溶液的方法是用平行光照射两种分散系(或丁达尔现象),故答案为:用平行光照射两种分散系(或丁达尔现象);
(2)氯化铁具有氧化性,能将Cu氧化为铜离子,而自身被还原为亚铁离子,离子方程式为2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+;
(3)废液中含有FeCl2、CuCl2,向废液中加入过量Fe,Fe置换出Cu,然后过滤,得到的滤渣C含有Fe和Cu,滤液B中含有FeCl2,向C中加入过量稀盐酸,Fe溶解生成FeCl2,铜不反应,然后过滤,得到的滤液中含有HCl、FeCl2,得到的滤渣为Cu;
将滤液B和E混合,将亚铁离子氧化为铁离子,且不能引进杂质,则F为氯水;
①通过以上分析知,滤渣C为Fe和Cu,故答案为:Fe、Cu;
②F的作用是将Fe2+转化为Fe3+,所以F应该具有氧化性,且不能引进杂质,酸性高锰酸钾溶液和溴水都具有氧化性但产生杂质,所以F应该是氯水,
故答案为:B;将溶液中的Fe2+转化为Fe3+;
(4)①铁离子和KSCN溶液混合生成络合物而使溶液呈血红色,取少量待测溶液,滴入KSCN溶液呈红色,说明溶液中含有铁离子,则一定还含有亚铁离子和铜离子,则待测液中含有的金属阳离子是Fe3+、Fe2+、Cu2+,故答案为:Fe3+、Fe2+、Cu2+;
②白色沉淀是AgCl,n(AgCl)=$\frac{25.83g}{143.5g/mol}$=0.18mol,根据Cl原子守恒得n(Cl-)=n(AgCl)=0.18mol,溶液中c(Cl-)=$\frac{n}{V}$=$\frac{0.18mol}{0.03L}$=6.0mol/L,
故答案为:6.0 mol•L-1.
点评 本题考查物质分离和提纯,为高频考点,涉及离子检验、物质的量浓度计算、氧化还原反应等知识点,知道铁离子、亚铁离子的检验方法及实验现象,会正确选取除杂剂及除杂方法,题目难度不大.

 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案| A. | 32克O2所含的原子数目为2NA | |
| B. | 常温常压下,6.2g Na2O含有的Na+离子数为0.2 NA | |
| C. | 标准状况下,22.4LCO2含有NA个分子 | |
| D. | 物质的量浓度为0.5mol•L-1的MgCl2溶液中,含有Cl-个数为NA |
 研究氮机器化合物对化工生产有重要意义.
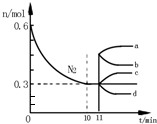
研究氮机器化合物对化工生产有重要意义.工业合成氨的原理为N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.如图表示在2L的恒容密闭容器中反应时N2的物质的量随时间的变化.
(1)图中0~10min内,用H2表示该反应的平均反应速率为0.045•L-1•min-1,从11min其其他条件不变,压缩容器的体积至1L,则n(N2)的变化曲线为d(填字母);
(2)下表为不同温度下(其他条件相同)该反应的平衡常数,由此可推知,三种温度下,反应从开始至达到平衡时所需时间最长的是T1(填“T1”“T2”或“T3”)
| T/℃ | T1 | T2 | T3 |
| K | 10 | 2.5 | 1.8 |
| A. | 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性 | |
| B. | 浓硝酸在光照下颜色变黄,说明浓硝酸不稳定 | |
| C. | 常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应 | |
| D. | 浓硫酸常温下与铜不反应,加热时才能发生反应 |

| A. | 四种毒品中都含有苯环,都属于芳香烃 | |
| B. | 摇头丸经消去、加成反应可制得冰毒 | |
| C. | 1mol大麻与溴水反应最多消耗4mol Br2 | |
| D. | 氯胺酮分子中环上所有碳原子可能共平面 |
| A. | HCHO | B. | CH3OH | C. | HCOOH | D. | CH3COOCH3 |
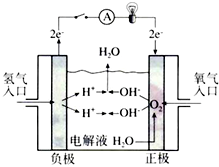 氢氧燃料电池已用于航天飞机.以30%KOH溶液为电解质溶液的这种电池在使用时的电极反应.试写出:
氢氧燃料电池已用于航天飞机.以30%KOH溶液为电解质溶液的这种电池在使用时的电极反应.试写出:
