题目内容
16.把质量为m g的铜丝灼烧变黑,立即放入下列物质中,使铜丝变红,而且质量仍为m g的是( )| A. | H2SO4 | B. | C2H5OH | C. | 稀HNO3 | D. | NaOH溶液 |
分析 铜丝灼烧变成黑色,则金属铜氧化生成了氧化铜,氧化铜可以和硫酸、乙醇、硝酸在一定的条件下反应,如反应前后质量不变,则CuO应被还原生成Cu,以此解答该题.
解答 解:A.铜丝灼烧成黑色,立即放入硫酸中,CuO与硫酸反应,生成铜盐,铜丝变红,铜丝质量减少,故A错误;
B.铜丝灼烧成黑色,立即放入C2H5OH中,CuO与C2H5OH反应:CuO+C2H5OH$\frac{\underline{\;\;△\;\;}}{\;}$CH3CHO+Cu+H2O,反应后铜丝变红,质量保持不变,故B正确;
C.铜丝灼烧成黑色,立即放入稀硝酸中,CuO、Cu与稀硝酸反应,生成铜盐,铜丝变红,铜丝质量减少,故C错误;
D.铜丝灼烧成黑色,加入氢氧化钠溶液不反应,质量较反应前大,故D错误.
故选B.
点评 本题考查铜及其化合物的性质,为高频考点,把握发生的反应及现象分析为解答的关键,注意Cu的质量变化,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
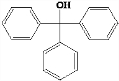
6. A、B、C、D为中学化学中常见的烃的含氧衍生物,他们有如图的转化关系:则下列判断正确的是( )
A、B、C、D为中学化学中常见的烃的含氧衍生物,他们有如图的转化关系:则下列判断正确的是( )
 A、B、C、D为中学化学中常见的烃的含氧衍生物,他们有如图的转化关系:则下列判断正确的是( )
A、B、C、D为中学化学中常见的烃的含氧衍生物,他们有如图的转化关系:则下列判断正确的是( )| A. | C→A的反应类型为加成反应 | |
| B. | 若A为2-丙醇,则其可实现如右图的所有转化 | |
| C. | 若A、B、D、为链状化合物,则C也一定为链状化合物 | |
| D. | A的相对分子质量小于C、D的相对分子质量而大于B的相对分子质量 |
7.在元素周期表中,过渡金属区域能找到( )
| A. | 制半导体材料的元素 | B. | 制农药的元素 | ||
| C. | 制催化剂的元素 | D. | 制耐高温合金的元素 |
11.设阿伏加德罗常数为NA,下列说法正确的是( )
| A. | 4.4g乙醛分子中含有的共用电子对数为0.6NA | |
| B. | 标准状况下,11.2L二氯甲烷所含分子数为0.5NA | |
| C. | 15.6g苯中含有碳碳双键的个数为0.6NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA |
1.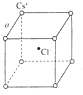 如右图是氯化铯晶体的晶胞示意图(晶体中最小的重复结构单元),已知晶体中2个最近的Cs+核间距为acm,氯化铯(CsCl)的相对分子质量M,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )
如右图是氯化铯晶体的晶胞示意图(晶体中最小的重复结构单元),已知晶体中2个最近的Cs+核间距为acm,氯化铯(CsCl)的相对分子质量M,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )
 如右图是氯化铯晶体的晶胞示意图(晶体中最小的重复结构单元),已知晶体中2个最近的Cs+核间距为acm,氯化铯(CsCl)的相对分子质量M,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )
如右图是氯化铯晶体的晶胞示意图(晶体中最小的重复结构单元),已知晶体中2个最近的Cs+核间距为acm,氯化铯(CsCl)的相对分子质量M,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )| A. | $\frac{8M}{{N}_{A}{a}^{3}}$g•cm-3 | B. | $\frac{M{a}^{3}}{{8N}_{A}}$g•cm-3 | C. | $\frac{M}{{N}_{A}{a}^{3}}$g•cm-3 | D. | $\frac{M{a}^{3}}{{N}_{A}}$g•cm-3 |
8.将Cu、Zn混合物投入稀HNO3中,充分反应后,锌有剩余,则反应后的肯定不存在的是
①Cu ②Cu(NO3)2 ③HNO3 ④Zn(NO3)2( )
①Cu ②Cu(NO3)2 ③HNO3 ④Zn(NO3)2( )
| A. | ①和② | B. | ②和③ | C. | ①和③ | D. | ②和④ |
5.将某黄铜矿(主要成分为CuFeS2)和O2在一定温度范围内发生反应,反应所得固体混合物X中含有CuSO4、FeSO4、Fe2(SO4)3及少量SiO2等,除杂后可制得纯净的胆矾晶体(CuSO4•5H2O).
(1)实验测得温度对反应所得固体混合物中水溶性铜(CuSO4)的含量的影响如图所示.生产过程中应将温度控制在600℃左右,温度升高至一定程度后,水溶性铜含量下降的可能原因是CuSO4发生了分解反应.
(2)下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).实验中可选用的试剂和用品:稀硫酸、3% H2O2溶液、CuO、玻璃棒、精密pH试纸.
①实验时需用约3%的H2O2溶液100mL,现用市售30%(密度近似为1g•cm-3)的H2O2来配制,其具体配制方法是用量筒量取10mL30%H2O2溶液加入烧杯中,再加入90mL 水(或加水稀释至 100mL),搅拌均匀.
②补充完整由反应所得固体混合物X制得纯净胆矾晶体的实验步骤:
第一步:将混合物加入过量稀硫酸,搅拌、充分反应,过滤.
第二步:向滤液中加入稍过量3% H2O2溶液,充分反应.
第三步:向溶液中加入CuO,用精密pH试纸控制pH在3.2~4.7之间,过滤.
第四步:加热浓缩、冷却结晶.
第五步:过滤、洗涤,低温干燥.
(3)在酸性、有氧条件下,一种叫Thibacillus ferroxidans的细菌能将黄铜矿转化成硫酸盐,该过程反应的离子方程式为4CuFeS2+4H++17O2=4Cu2++4Fe3++8SO42-+2H2O.

(1)实验测得温度对反应所得固体混合物中水溶性铜(CuSO4)的含量的影响如图所示.生产过程中应将温度控制在600℃左右,温度升高至一定程度后,水溶性铜含量下降的可能原因是CuSO4发生了分解反应.
(2)下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).实验中可选用的试剂和用品:稀硫酸、3% H2O2溶液、CuO、玻璃棒、精密pH试纸.
①实验时需用约3%的H2O2溶液100mL,现用市售30%(密度近似为1g•cm-3)的H2O2来配制,其具体配制方法是用量筒量取10mL30%H2O2溶液加入烧杯中,再加入90mL 水(或加水稀释至 100mL),搅拌均匀.
②补充完整由反应所得固体混合物X制得纯净胆矾晶体的实验步骤:
第一步:将混合物加入过量稀硫酸,搅拌、充分反应,过滤.
| 粒子 | Cu2+ | Fe2+ | Fe3+ |
| 开始沉淀时的pH | 4.7 | 5.8 | 1.9 |
| 完全沉淀时的pH | 6.7 | 9.0 | 3.2 |
第三步:向溶液中加入CuO,用精密pH试纸控制pH在3.2~4.7之间,过滤.
第四步:加热浓缩、冷却结晶.
第五步:过滤、洗涤,低温干燥.
(3)在酸性、有氧条件下,一种叫Thibacillus ferroxidans的细菌能将黄铜矿转化成硫酸盐,该过程反应的离子方程式为4CuFeS2+4H++17O2=4Cu2++4Fe3++8SO42-+2H2O.

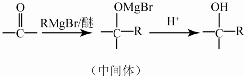
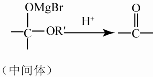

 .
.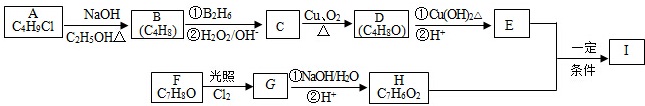
 +2Cl2$\stackrel{光照}{→}$
+2Cl2$\stackrel{光照}{→}$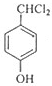 +2HCl,该反应类型为取代反应.
+2HCl,该反应类型为取代反应. .
. .
.