题目内容
20.取pH均等于2的盐酸和醋酸溶液各100mL.分别稀释2倍后,再分别加入0.03g锌粉,在相同条件下充分反应,有关叙述正确的是( )| A. | 醋酸与锌反应放出的氢气多 | |
| B. | 盐酸和醋酸分别与锌反应放出的氢气一样多 | |
| C. | 醋酸与锌反应所需时间长 | |
| D. | 盐酸和醋酸分别与锌反应所需时间一样长 |
分析 pH均等于2的盐酸和醋酸,氯化氢是强电解质,醋酸是弱电解质,所以c(CH3COOH)>c(HCl),等pH等体积的盐酸和醋酸,n(CH3COOH)>n(HCl),盐酸和醋酸分别与足量锌反应时,酸的物质的量越多,生成氢气的量越大,酸与锌反应速率与氢离子浓度有关,氢离子浓度越大,反应速率越快,pH均等于2的盐酸和醋酸,加水稀释2倍后,醋酸溶液中氢离子浓度大于盐酸,pH均等于2的盐酸和醋酸溶液各100mL,含有氢离子物质的量为0.002mol,能够反应Zn的质量为0.065g,所以0.03gZn能够完全反应,生成氢气的量相同.
解答 解:A.pH均等于2的盐酸和醋酸溶液各100mL,含有氢离子物质的量为0.002mol,能够反应Zn的质量为0.065g,所以0.03gZn能够完全反应,生成氢气的量相同,故A才错误;
B.pH均等于2的盐酸和醋酸溶液各100mL,含有氢离子物质的量为0.002mol,能够反应Zn的质量为0.065g,所以0.03gZn能够完全反应,生成氢气的量相同,故B正确;
C.Zn能够完全反应,当pH=2的盐酸和醋酸稀释2倍后,醋酸中氢离子浓度大于盐酸,所以醋酸反应速率快,盐酸与锌反应所需时间长,故C错误;
D.当pH=2的盐酸和醋酸稀释2倍后,醋酸中氢离子浓度大于盐酸,所以醋酸反应速率大,盐酸与锌反应所需时间长,故D错误;
故选A.
点评 本题考查弱电解质电离,明确生成的氢气和酸的关系、反应速率和氢离子浓度关系即可解答,难度不大.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
10.研究发现铜具有独特的杀菌功能,能较好地抑制病菌的生长.现有工业上由辉铜矿石(主要成分Cu2S)的冶炼铜两种方案:
Ⅰ火法炼铜 在1200℃发生的主要反应为:
①2Cu2S+3O2=2Cu2O+2SO2 ②2Cu2O+Cu2S=6Cu+SO2↑
此方案的尾气可以用表中方法处理
Ⅱ“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如溶液中亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强;利用Fe2(SO4)3作氧化剂溶解辉铜矿石,溶液酸性又进一步增强,过滤未溶解完的辉铜矿石,在滤液中加入足量的铁屑,待反应完全后过滤出铜和剩余的铁屑,得溶液Xml(设整个过程中其它杂质不参与反应,不考虑溶液离子水解).其流程如图:
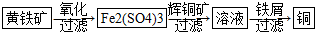
(1)Ⅱ相对于Ⅰ的优点是能大大降低能源消耗,利于减少污染或对贫矿、尾矿的开采更有价值.(说一点即可)
(2)Ⅰ中反应2Cu2O+Cu2S=6Cu+SO2↑氧化剂是Cu2O、Cu2S
(3)已知CO的燃烧热283.0kJ•mol-1,写出S(g)与O2(g)反应生成SO2(g)的热化学方程式S(g)+O2(g)═SO2(g)△H=-574.0kJ•mol-1
(4)若用Ⅰ中方法2吸收尾气,则开始时阳极的电极反应式为HSO3-+H2O-2e-=SO42-+3H+.
(5)写出Ⅱ中黄铁矿氧化过程的化学反应方程式4FeS2+15O2+2H2O $\frac{\underline{\;细菌\;}}{\;}$2Fe2(S04)3+2H2S04
(6)假设Ⅱ中每一步都完全反应,消耗掉标况下空气5×22.4VL(氧气体积分数为20%),则所得c(Fe2+)=$\frac{\frac{42}{75}mol}{v×1{0}^{-3}L}$(可以写表达式)
Ⅰ火法炼铜 在1200℃发生的主要反应为:
①2Cu2S+3O2=2Cu2O+2SO2 ②2Cu2O+Cu2S=6Cu+SO2↑
此方案的尾气可以用表中方法处理
| 方法1 | 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫,其部分热化学方程式为: 2CO(g)+SO2(g)=S(g)+2CO2(g)△H=+8.0kJ•mol-1 2H2(g)+SO2(g)=S(g)+2H2O(g)△H=+90.4kJ•mol-1 |
| 方法2 | 用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸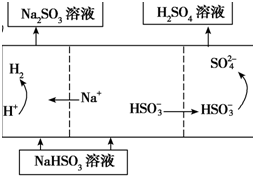 |
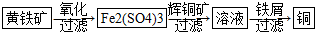
(1)Ⅱ相对于Ⅰ的优点是能大大降低能源消耗,利于减少污染或对贫矿、尾矿的开采更有价值.(说一点即可)
(2)Ⅰ中反应2Cu2O+Cu2S=6Cu+SO2↑氧化剂是Cu2O、Cu2S
(3)已知CO的燃烧热283.0kJ•mol-1,写出S(g)与O2(g)反应生成SO2(g)的热化学方程式S(g)+O2(g)═SO2(g)△H=-574.0kJ•mol-1
(4)若用Ⅰ中方法2吸收尾气,则开始时阳极的电极反应式为HSO3-+H2O-2e-=SO42-+3H+.
(5)写出Ⅱ中黄铁矿氧化过程的化学反应方程式4FeS2+15O2+2H2O $\frac{\underline{\;细菌\;}}{\;}$2Fe2(S04)3+2H2S04
(6)假设Ⅱ中每一步都完全反应,消耗掉标况下空气5×22.4VL(氧气体积分数为20%),则所得c(Fe2+)=$\frac{\frac{42}{75}mol}{v×1{0}^{-3}L}$(可以写表达式)
8.下面是人们对于化学科学的各种常见的认识,其中错误的是( )
| A. | 化学将为环境、能源、资源等问题的解决提供有力保障 | |
| B. | 化学正发展成为一门实验与理论互相结合、互相渗透的科学 | |
| C. | 化学是一门具有极强实用性的自然科学 | |
| D. | 化学是一门纯实验的自然科学,实验是探究化学过程的唯一途径 |
5.关于下列图示装置运用的叙述正确的是( )
①装置甲可防止铁钉生锈
②装置乙可除去乙烷中混有的乙烯
③装置丙可验证HCl气体在水中的溶解性
④装置丁可除去乙酸乙酯中混有的乙酸
⑤装置戊可用于收集H2、CO2、Cl2、HCl、NO2等气体.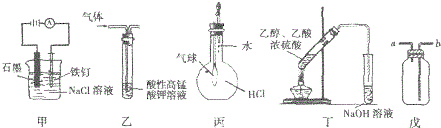
①装置甲可防止铁钉生锈
②装置乙可除去乙烷中混有的乙烯
③装置丙可验证HCl气体在水中的溶解性
④装置丁可除去乙酸乙酯中混有的乙酸
⑤装置戊可用于收集H2、CO2、Cl2、HCl、NO2等气体.

| A. | ③⑤ | B. | ③④ | C. | ①②④ | D. | ①③⑤ |
9.下列实验操作中正确的是( )
| A. | 用湿润的pH试纸测定某稀醋酸溶液的pH | |
| B. | 做完银镜反应的试管可以用氨水来洗涤 | |
| C. | 为了除去苯中混有的少量苯酚,加入足量浓溴水,充分搅拌后过滤分离 | |
| D. | 如果苯酚浓溶液沾到皮肤上,应立即用酒精擦洗 |
 )组成的混合气体与足量的H2反应,充分加成后,生成4.4g3种对应的烷径中一定有( )
)组成的混合气体与足量的H2反应,充分加成后,生成4.4g3种对应的烷径中一定有( ) ;1124Na.
;1124Na.
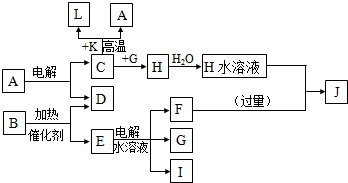
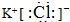 .
.