题目内容
19.下列各组物质沸点大小关系正确的是( )①CH3CH2CH2OH>CH3(CH2)2CH3
②CH3(CH2)2CH3>CH3CH(CH3)2
③苯酚>苯
④CH3CH2Br>CH3CH2OH
⑤
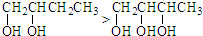
| A. | ①④ | B. | ②④⑤ | C. | ①②③ | D. | ③④⑤ |
分析 烷烃中中,碳原子个数越多其熔沸点越高;烷烃的同分异构体中,支链越少熔沸点越高;能形成氢键的物质熔沸点较高;醇中羟基个数越多其熔沸点越高,据此分析解答.
解答 解:①CH3CH2CH2OH中能形成氢键,丁烷中不存在氢键,所以熔沸点CH3CH2CH2OH>CH3(CH2)2CH3 ,故正确;
②同分异构体中支链越少熔沸点越高,所以熔沸点CH3(CH2)2CH3>CH3CH(CH3)2,故正确;
③苯酚中存在羟基、苯中不存在羟基,所以熔沸点苯酚>苯,故正确;
④乙醇中含有氢键、溴乙烷不含氢键,所以熔沸点CH3CH2Br<CH3CH2OH,故错误;
⑤羟基个数越多,其熔沸点越高,所以熔沸点前者小于后者,故错误;
故选C.
点评 本题考查晶体熔沸点高低判断,为高频考点,晶体熔沸点高低与晶体类型有关、分子晶体熔沸点与相对分子质量及氢键有关,知道常见含有氢键的物质,题目难度不大.

练习册系列答案
相关题目
9.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
| A. | 用惰性电极电解饱和食盐水时,阳极的电极反应式为:2Cl-═Cl2↑+2e- | |
| B. | 氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- | |
| C. | 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu═Cu2++2e- | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe═Fe2++2e- |
10.某原电池反应的离子方程式为Fe+2H+═Fe2++H2↑,则下列说法正确的是( )
| A. | 稀硝酸为电解质溶液 | B. | 锌为原电池正极 | ||
| C. | 铁极质量不变 | D. | 铜为原电池正极 |
14.下列表达反应的化学用语正确的是( )
| A. | 苯酚与纯碱溶液混合反应的离子方程式:2C6H5OH+CO32-→CO2↑+H2O+2C6H5O- | |
| B. | 溴乙烷发生水解反应的离子方程式:CH3CH2Br+OH-$→_{△}^{H_{2}O}$CH3CH2O-+H++Br- | |
| C. | 丙烯与水发生加成反应的化学方程式:CH2=CH-CH3+H2O$→_{△}^{催化剂}$CH3-O-CH2-CH3 | |
| D. | 苯酚稀溶液中加入饱和溴水: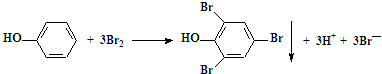 |
11.某链状含单官能团的有机物W,只含C、H、O三元素,其蒸气的密度是CO2的2倍(相同条件下),取一定量的有机物W完全燃烧生成CO2和 H2O的质量比为22:9.则W的结构共有( )种(不考虑立体结构)
| A. | 10 | B. | 8 | C. | 6 | D. | 4 |
8. 化学小组采用类似制乙酸乙酯的装置(如图),用环己醇制备环己烯.
化学小组采用类似制乙酸乙酯的装置(如图),用环己醇制备环己烯.
已知:
(1)制备粗品:将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片(防止暴沸),缓慢加热至反应安全,在试管C内得到环己烯粗品.
①导管B除了导气外还具有的作用是冷凝.
②试管C置于冰水浴中的目的是使环己烯液化,减少挥发.
(2)①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静止、分层,环己烯在上层(填“上”或“下”),分液后用C(填选项字母)洗涤.
A、KMnO4溶液 B、稀H2SO4 C、Na2CO3溶液
②蒸馏收集产品时,控制的温度应在83℃左右,实验制得的环己烯精品质量低于理论产量,可能的原因是C(填选项字母).
A、蒸馏时从70℃开始收集产品
B、环己醇实际用量多了
C、制备粗品时环己醇随产品一起蒸出.
 化学小组采用类似制乙酸乙酯的装置(如图),用环己醇制备环己烯.
化学小组采用类似制乙酸乙酯的装置(如图),用环己醇制备环己烯.已知:

| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 难溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
①导管B除了导气外还具有的作用是冷凝.
②试管C置于冰水浴中的目的是使环己烯液化,减少挥发.
(2)①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静止、分层,环己烯在上层(填“上”或“下”),分液后用C(填选项字母)洗涤.
A、KMnO4溶液 B、稀H2SO4 C、Na2CO3溶液
②蒸馏收集产品时,控制的温度应在83℃左右,实验制得的环己烯精品质量低于理论产量,可能的原因是C(填选项字母).
A、蒸馏时从70℃开始收集产品
B、环己醇实际用量多了
C、制备粗品时环己醇随产品一起蒸出.
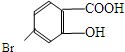 ,它的含氧官能团名称为羧基、羟基.
,它的含氧官能团名称为羧基、羟基.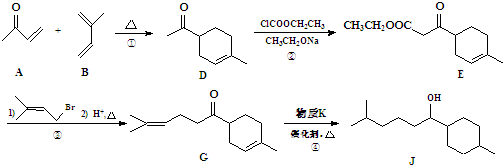
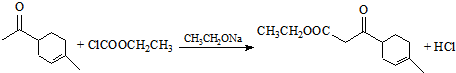
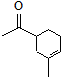 .
.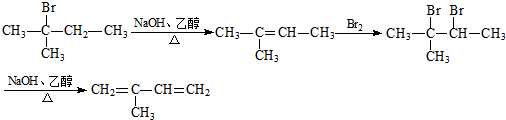 .
.